
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、SO
、SO![]()
B.能使紫色石蕊试液变红的溶液:Al3+、Fe3+、NO![]() 、Cl-
、Cl-
C.滴加KSCN溶液显红色的溶液:Ba2+、K+、Cl-、OH-
D.与铝反应产生大量氢气的溶液:Na+、Mg2+、CO![]() 、NO
、NO![]()
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH
NH![]() +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热⑥加入少量MgSO4固体
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molX和2molY进行如下反应:3X(g)+2Y(g)![]() 4Z(s)+2W(g),反应一段时间后达到平衡,测得生成1.6molZ,则下列说法正确的是( )
4Z(s)+2W(g),反应一段时间后达到平衡,测得生成1.6molZ,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=![]()
B.此时,Y的平衡转化率是40%
C.增大该体系的压强,化学平衡常数增大
D.增加Y,Y的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。
(1)某学习小组利用 DIS 系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000 mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000 mol/L的NaOH溶液分别滴定10.00 mL 0.1000 mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
③由计算机绘制的滴定曲线如图:
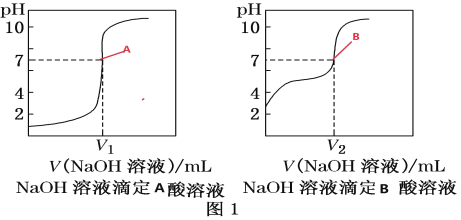
(2)①A是_____酸(填“醋酸”或“盐酸”)
②两曲线图中 V1________V2(填“>”“=”或“<”),A点和B点,水的电离程度_____(填“A 点大”、“B 点大”、“A 和 B 点相同”或“无法判断”)
(3)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用________(填仪器名称)量取 20.00 mL 醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好 DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果?______(填“是”“否”或“不能确定”)。向锥形瓶中滴加 0.1000 mol/L的NaOH溶液,计算机屏幕上显示溶液导电能力与加入NaOH溶液体积关系的曲线图(见如图)。
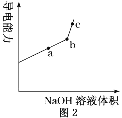
②醋酸与NaOH溶液反应的离子方程式为______。
③图中b点时,溶液中各离子浓度大小的关系是_________,c(CH3COOH)+c(CH3COO-)=_________mol/L。
④若图中某一点 pH 等于8,则 c(Na+)-c(CH3COO-)的精确值为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
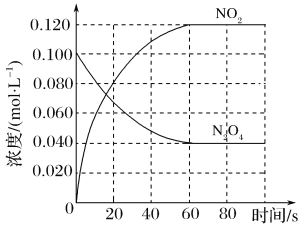
该反应ΔH______0(填“>”、“<”或“=”),在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。平衡常数K=________________(请书写单位)。在温度不变的情况下向平衡体系中再充入N2O4 0.01mol·L-1和NO20.03mol·L-1此时v(正)___________v(逆)(填“>”、“<”或“=”)。有利于提高反应N2O4(g) ![]() 2NO2(g)平衡转化率的条件是________(填标号)。
2NO2(g)平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在一定温度下,向a L密闭容器中加入1 molN2O4(g)发生如下反应:N2O4(g) ![]() 2NO2(g),不能说明该反应一定达平衡的是__________。
2NO2(g),不能说明该反应一定达平衡的是__________。
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1:2:2
D.单位时间内生成1 mol N2O4(g),同时生成2 mol NO2
E.混合气体的密度不随时间变化
F.混合气体的颜色不随时间变化
(3)在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是__________
A. 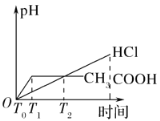 B.
B. 
C. 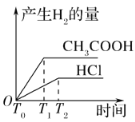 D.
D. 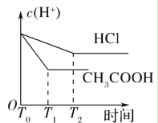
(4)25 ℃时,一元弱酸HA溶液Kal=4.3×10-4 ,一元弱酸HB溶液Ka2=5.6×10-4则酸性HA____________HB(填“>”、“<”或“=”)。
(5)常温下0.001mol·L-1的H2SO4溶液与0.004mol·L-1的NaOH溶液1:1体积比混合,混合后溶液的pH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产生活有重要的影响。800℃时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,回答下列问题:

(1)该反应的生成物是________。
(2)2min内,C的反应速率为________。
(3)该反应的化学方程式为________。
(4)在其他条件下,测得A的反应速率为![]() ,此时的反应速率与800℃时相比_____。
,此时的反应速率与800℃时相比_____。
A.比800℃时慢 B.比800℃时快 C.和800℃时速率一样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Ni原子价电子中成对电子数与未成对电子数之比为_________。
(2)MgO与CaO这两个物质,其中熔点较高的是______,原因是___________________________________________。
(3)第二周期中,第一电离能介于B元素和N元素之间的元素有_________种。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合, 其结构如图所示。
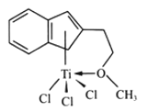
①组成M的元素中,电负性最大的是__________ (填名称)。
②M中碳原子的杂化方式为__________。
③M中不含__________ (填代号)。
a、π键 b、σ键 c、离子键 d、配位键
(5)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为________________。
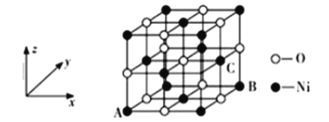
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 分别取样:
分别取样:![]() 测得溶液显弱酸性;
测得溶液显弱酸性;![]() 滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是
滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是
A. 焰色反应 B. NaOH溶液(加热)
C. ![]() 酸化
酸化![]() 溶液 D.
溶液 D. ![]() 气体
气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com