
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和 NaOH 反应的中和热 H=-57.3kJ·mol-1,则H2SO4 和 Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是 283.0kJ·mol-1 则 2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1
C.反应物的总能量低于生成物的总能量时,反应一定不能自发进行
D.一定的温度和一定的压强下,将 0.5molN2 和1.5molH2 置于密闭容器中充分反应,放热19.3kJ,热化学方程式为 N2+3H2![]() 2NH3 ΔH=-38.6kJ·mol-1
2NH3 ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
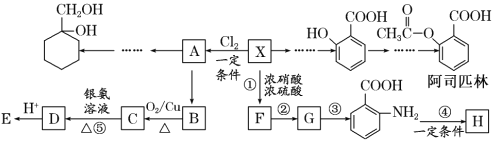
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:Ⅰ.![]()
Ⅱ.![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X→A的反应条件是____。
(2)H的结构简式是____。
(3)反应③④的类型是____、____。
(4)反应⑤的化学方程式是____。
(5) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
(6)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 的最合理的方案(不超过4步)__________。
的最合理的方案(不超过4步)__________。
例如:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、SO
、SO![]()
B.能使紫色石蕊试液变红的溶液:Al3+、Fe3+、NO![]() 、Cl-
、Cl-
C.滴加KSCN溶液显红色的溶液:Ba2+、K+、Cl-、OH-
D.与铝反应产生大量氢气的溶液:Na+、Mg2+、CO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子,分别取样,
离子,分别取样,![]() 测得溶液显弱碱性;
测得溶液显弱碱性;![]() 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是
加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
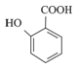
【题目】如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请回答下列问题:
(1)仪器戊的名称为___。
(2)实验时甲中所发生反应的化学方程式为___。
(3)乙中盛放的试剂是___,其作用是___;丙中盛放的试剂是___,其作用是___。
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是___。
(5)碱石灰的作用是___(答出一条即可)。
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为___,后通过___(填实验操作名称),即可得到PCl3纯品。
查看答案和解析>>
科目:高中化学 来源: 题型:
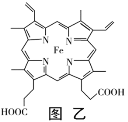
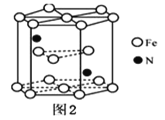
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
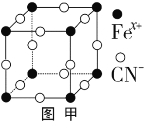
(2)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为___________。
(3)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)_____________
(4)某种磁性氮化铁的结构如图2所示,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,物质的量均为0.3mol的X(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),ΔH=-akJ·mol-1,下列说法正确的是( )
2Z(g),ΔH=-akJ·mol-1,下列说法正确的是( )
A.反应一段时间后,X与Y的物质的量之比仍为1:1
B.达到平衡时,反应放出0.1akJ的热量
C.达到平衡后,向平衡体系中充入稀有气体,正反应速率不发生变化
D.X的体积分数保持不变,说明反应已达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com