
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
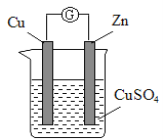
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
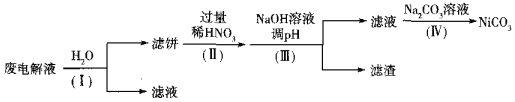
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子,分别取样,
离子,分别取样,![]() 测得溶液显弱碱性;
测得溶液显弱碱性;![]() 加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是
加入足量盐酸,有无色无味气体产生。为确定溶液组成,还需要检测的离子是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
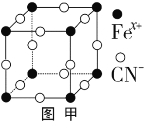
(2)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为___________。
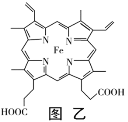
(3)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)_____________
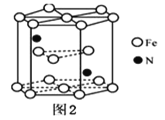
(4)某种磁性氮化铁的结构如图2所示,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
,则该化合物的化学式为___________。 其中铁原子最近的铁原子的个数为________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为______ g·cm-3 (用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
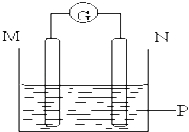
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
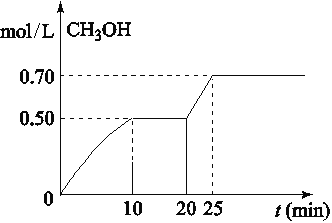
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究构成原电池的条件,装置如图所示:
甲.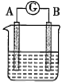 乙.
乙.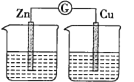
实验一:探究电极的构成。图甲中,①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③A极用锌片,B极用铜片,发现电流计指针向左偏转;④A极用锌片,B极用石墨,发现电流计指针向左偏转。
(1)结论一:________________________;
实验二:探究溶液的构成。图甲中,A极用锌片,B极用铜片,①液体采用无水乙醇,发现电流计指针不偏转;②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
(2)结论二:________________________;
实验三:探究图乙装置能否构成原电池。将锌、铜两电极分别放入稀硫酸中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
(3)结论三:________________________;
思考:对该同学的实验,有同学提出了如下疑问,请你帮助解决。
(4)在图甲装置中,若A为镁片,B为铝片,电解质溶液为![]() 溶液;负极为________(填“A”或“B”);电流计的指针应向________(填“右”或“左”)偏转。
溶液;负极为________(填“A”或“B”);电流计的指针应向________(填“右”或“左”)偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 A是一种化肥,受热分解生成三种物质,物质间的有关转换关系如图所示,部分生成物已省略,其中C为无色气体,B为无色液体,D 为无色有刺激性气味的气体,B到E的反应条件为通电,I为一种常见强酸。
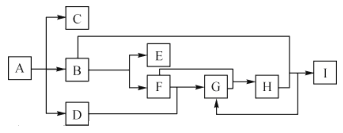
请回答下列问题:
(1)A的化学式为___________________________。
(2)C的水化物与I的酸性由强到弱的顺序:___________________(用化学式填空)
(3)B生成E的化学方程式为_____________________。
(4)金属铜与I的稀溶液反应的离子方程式为_____________,该反应中还原产物是 ______,生成1mo1的还原产物,转移电子的数目为__________NA。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com