
【题目】化合物 A是一种化肥,受热分解生成三种物质,物质间的有关转换关系如图所示,部分生成物已省略,其中C为无色气体,B为无色液体,D 为无色有刺激性气味的气体,B到E的反应条件为通电,I为一种常见强酸。
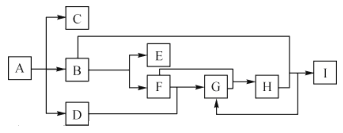
请回答下列问题:
(1)A的化学式为___________________________。
(2)C的水化物与I的酸性由强到弱的顺序:___________________(用化学式填空)
(3)B生成E的化学方程式为_____________________。
(4)金属铜与I的稀溶液反应的离子方程式为_____________,该反应中还原产物是 ______,生成1mo1的还原产物,转移电子的数目为__________NA。
【答案】NH4HCO3或(NH4)2CO3 HNO3>H2CO3 2H2O ![]() 2H2↑+O2↑ 3Cu+8H+ +2NO3-= 3Cu2+ +2NO↑+4H2O NO 3
2H2↑+O2↑ 3Cu+8H+ +2NO3-= 3Cu2+ +2NO↑+4H2O NO 3
【解析】
化合物 A是一种化肥,受热分解生成三种物质,其中C为无色气体,B为无色液体,D 为无色有刺激性气味的气体,A是碳酸氢铵或碳酸铵,C是二氧化碳,B是水,D是氨气,B到E的反应条件为通电,E是氢气,F是氧气,F和D反应生成G,G是一氧化氮,H为二氧化氮,I为一种常见强酸,是硝酸。
根据分析可知,A为碳酸氢铵或碳酸铵,C是二氧化碳,B是水,D是氨气,E是氢气,F是氧气,G是一氧化氮,H为二氧化氮,I为硝酸。
(1)A是碳酸氢铵或碳酸铵,化学式为NH4HCO3或(NH4)2CO3;
(2)C的水化物为碳酸,I为硝酸,N的非金属性强于C,故酸性:HNO3>H2CO3;
(3)B在通电的条件下生成E和F,化学方程式为电解水,2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)铜与稀硝酸反应生成硝酸铜,一氧化氮和水,离子方程式为3Cu+8H++2NO3-= 3Cu2+ +2NO↑+4H2O,硝酸中的氮元素化合价从+5降低到+2,是氧化剂,得到的一氧化氮是还原产物,生成2molNO转移6mol电子,故生成1mo1的NO,转移3mol电子,数目为3NA。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
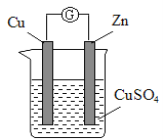
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
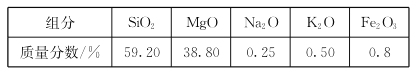
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
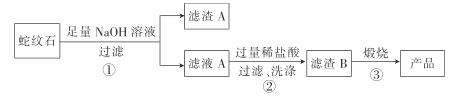
(1)蛇纹石中涉及的可溶性金属氧化物有___________________(写化学式)。
(2)步骤①中涉及SiO2 反应的离子方程式为_________________________ 。
(3)滤渣 A的成分有__________________ (填化学式)。
(4)步骤②中洗涤沉淀的方法是 _____________________________________________。
(5)步骤③反应的化学方程式为 _______________________________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、________和____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的①C2H4②C2H6O完全燃烧,消耗氧气物质的量关系为______(填编号,用“>”“<”或“=”表示).
(2)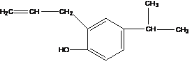 的分子式为____________.
的分子式为____________.
(3)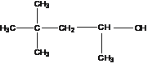 系统命名为____________________________.
系统命名为____________________________.
(4)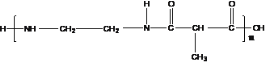 的单体为___________________.
的单体为___________________.
(5)3-甲基-1-丁醇消去的反应方程式________________________________.
(6)2-甲基-2-氯丙烷水解的反应方程式__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究和比较二氧化硫和氯水的漂白性,设计了如图所示的实验装置。
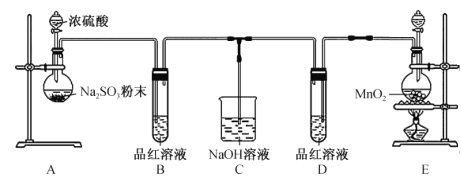
回答下列问题:
(1)装置A中反应的化学方程式为____________________________________;制备SO2时选用浓硫酸而不用稀硫酸的主要原因是 ____________________________。
(2)实验室用装置E制备C12,反应的离子方程式为 __________________________。若有8.7gMnO2参加反应,则转移的电子的物质的量为 ______________。
(3)反应开始一段时间后,观察到装置B、D中的品红溶液出现的现象是____________。
(4)小组中甲同学认为SO2和氯水都有漂白性,若二者混合使用,漂白性会更强。为验证甲同学的推断,在同温同压下,他们同时将SO2和C12等体积通入到品红溶液中,结果发现品红溶液_____________(填字母)。
a.很快褪色 b.几乎不褪色 c.先褪色后复原
出现上述现象的原因是________________________________ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
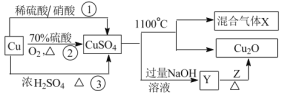
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
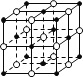
A.含16g氧原子的二氧化硅晶体中含有的σ键数目为 NA
B.58.5 g NaCl晶体中含有0.25NA个上图所示的结构单元
C.常温常压下,5gD2O含有的质子数、电子数、中子数均为2.5NA
D.标准状况下,22.4L乙烷中含有极性键的数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO(NH2)2分子中含有σ键与π键的数目之比为:______,N原子的杂化类型为______。
(2)类卤素(SCN)2与卤素性质相似,对应的酸有两种,理论上硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点,其原因是:_________________________。
(3)S能形成很多种含氧酸根离子,如SO32-、SO42-、S2O72-,已知S2O72-的结构中所有原子都达到稳定结构,且不存在非极性键,由该离子组成二元酸的分子式为H2S2O7,试写出其结构式_____________________________。
(4)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:含氧酸酸性强弱与非羟基氧原子数的关系。
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,
则H3PO3与过量的NaOH溶液反应的化学方程式是:__________________________,
在H3AsO3中加入足量的浓盐酸,写出化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com