
【题目】(1)CO(NH2)2分子中含有σ键与π键的数目之比为:______,N原子的杂化类型为______。
(2)类卤素(SCN)2与卤素性质相似,对应的酸有两种,理论上硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点,其原因是:_________________________。
(3)S能形成很多种含氧酸根离子,如SO32-、SO42-、S2O72-,已知S2O72-的结构中所有原子都达到稳定结构,且不存在非极性键,由该离子组成二元酸的分子式为H2S2O7,试写出其结构式_____________________________。
(4)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:含氧酸酸性强弱与非羟基氧原子数的关系。
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,
则H3PO3与过量的NaOH溶液反应的化学方程式是:__________________________,
在H3AsO3中加入足量的浓盐酸,写出化学方程式:___________________________。
【答案】7:1 sp3 异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键(或异硫氰酸分子间可形成氢键) 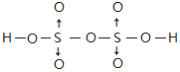 H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3HCl=AsCl3+3H2O
H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3HCl=AsCl3+3H2O
【解析】
(1)根据杂化轨道理论分析N原子的轨道杂化类型;
(2)根据二者的结构特点以及氢键对物质熔沸点的影响分析作答;
(3)H2S2O7属于二元酸,根据已知H2S2O7的结构特点分析其结构;
(4)根据无机含氧酸的酸性强弱规律分析亚磷酸和亚砷酸的结构,并分别写出相应的化学方程式。
(1)CO(NH2)2分子的结构式为![]() ,则其含有的σ键与π键的数目之比为7:1;N原子与其他3个原子形成3个σ键,且有一个孤电子对,则其价层电子对数为4,采取sp3杂化;
,则其含有的σ键与π键的数目之比为7:1;N原子与其他3个原子形成3个σ键,且有一个孤电子对,则其价层电子对数为4,采取sp3杂化;
(2)由异硫氰酸分子和硫氰酸分子的结构式可知,异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,故硫氰酸(HSC≡N)的沸点低于异硫氰酸(HN=C=S)的沸点;
(3)含氧酸H2S2O7属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,即不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键,其结构式为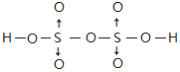 ;
;
(4)无机含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,所以亚磷酸含有一个非羟基氧原子,亚砷酸不含非羟基氧原子,则亚磷酸和亚砷酸的结构式分别为: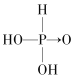 、
、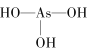 ,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,但有弱碱性,则H3PO3与过量的NaOH溶液反应的化学方程式是:H3PO3+2NaOH=Na2HPO3+2H2O,H3AsO3与足量的浓盐酸反应的化学方程式是:H3AsO3+3HCl=AsCl3+3H2O。
,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,但有弱碱性,则H3PO3与过量的NaOH溶液反应的化学方程式是:H3PO3+2NaOH=Na2HPO3+2H2O,H3AsO3与足量的浓盐酸反应的化学方程式是:H3AsO3+3HCl=AsCl3+3H2O。


科目:高中化学 来源: 题型:
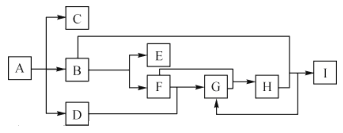
【题目】化合物 A是一种化肥,受热分解生成三种物质,物质间的有关转换关系如图所示,部分生成物已省略,其中C为无色气体,B为无色液体,D 为无色有刺激性气味的气体,B到E的反应条件为通电,I为一种常见强酸。
请回答下列问题:
(1)A的化学式为___________________________。
(2)C的水化物与I的酸性由强到弱的顺序:___________________(用化学式填空)
(3)B生成E的化学方程式为_____________________。
(4)金属铜与I的稀溶液反应的离子方程式为_____________,该反应中还原产物是 ______,生成1mo1的还原产物,转移电子的数目为__________NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
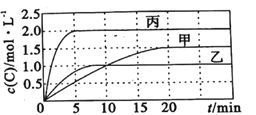
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫酸既表现了氧化性又表现了酸性的是( )
A.2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaNO3![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:
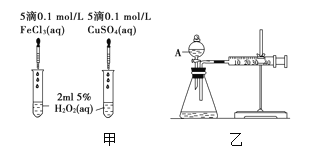
(1)定性如图甲可通过观察_________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________。写出H2O2在二氧化锰作用下发生反应的化学方程式____。
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验因素均已忽略。检查该装置气密性的方法是__________________。图中仪器A名称为________,实验中需要测量的数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
(1)写出![]() 溶液与稀硫酸反应的离子方程式___________,等物质的量的
溶液与稀硫酸反应的离子方程式___________,等物质的量的![]() 与
与![]() 固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为________。
固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为________。
(2)在![]() 稀
稀![]() 反应中,________是氧化剂;________是还原剂;氧化剂与还原剂的物质的量之比为__________
反应中,________是氧化剂;________是还原剂;氧化剂与还原剂的物质的量之比为__________
(3)向酸性高锰酸钾溶液中滴加硫酸亚铁,紫色逐渐褪去,写出该反应的离子方程式: _______。
(4)将![]() 的钠、镁、铝分别投入
的钠、镁、铝分别投入![]() 的硫酸溶液中,三者产生氢气的体积比是________。
的硫酸溶液中,三者产生氢气的体积比是________。
(5)等质量的Fe分别与足量的![]() 、S、
、S、![]() 反应转移电子数之比为_______;
反应转移电子数之比为_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种植物合成叶绿素的催化剂,也可用于制备多种含锰物质。
回答下列问题:
⑴工业上可用惰性电极电解MnSO4溶液的方法制备MnO2,其阳极的电极反应式为________。
⑵我国普遍采用两矿加酸法制备MnSO4。两矿指软锰矿(主要成分MnO2,含少量Al2O3和SiO2)、黄铁矿(FeS2)。生产MnSO4的工艺流程如下:
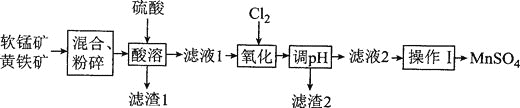
①软锰矿和黄铁矿需按一定比例混合,若黄铁矿过量太多,将导致的主要后果为________。
②“酸溶”时,黄铁矿被氧化为Fe3+、SO42-的离子方程式为________,该操作需控制在90℃,温度不能过低的原因为________。
③若使“氧化”的溶液中杂质离子除净,“调pH”应不小于________![]() 保留两位有效数字
保留两位有效数字![]() 。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
。已知:Mn(OH)2、Al(OH)3、Fe(OH)3的Ksp分别为2.0×10-13、1.0×10-33、4.0×10-38,溶液中离子浓度小于等于10-5 mol·L-1时,认为该离子沉淀完全。
④MnSO4的溶解度曲线如图所示,则“操作I”,为________、________、用热水洗涤、干燥。
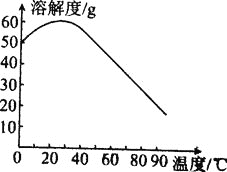
⑶用(NH4)2S2O8溶液鉴别溶液中Mn2+的现象为溶液变为紫红色。所发生反应中氧化剂和还原剂的物质的量之比为________。S2O82-中含有1个过氧键。则其中S元素的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
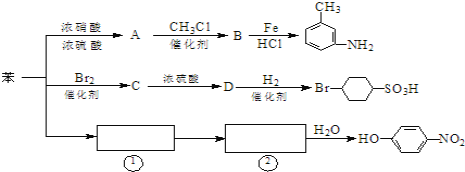
(1)A转化为B的化学方程式是____________________
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:①____,②_____
(3)有机物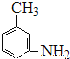 的所有原子___________(填“是”或“不是”)在同一平面上。
的所有原子___________(填“是”或“不是”)在同一平面上。
(4)有机物B苯环上的二氯代物有_____________种结构。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com