
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
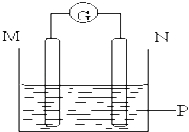
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
【答案】C
【解析】
试题分析:该装置没有外接电源,是原电池;M棒变粗,N棒变细,说明N极失电子作负极,M极得电子作正极;M棒变粗,所以溶液中的金属阳离子析出生成金属单质,电解质溶液中的阳离子为金属阳离子且活泼性小于N,原电池正负极的判断方法:
1、根据电极材料的活泼性判断
负极:活泼性相对强的一极
正极:活泼性相对弱的一极
2、根据电子流向或电流的流向判断
负极:电子流出或电流流入的一极
正极:电子流入或电流流出的一极
3、根据溶液中离子移动的方向判断
负极:阴离子移向的一极
正极:阳离子移向的一极
4、根据两极的反应类型判断
负极:发生氧化反应的一极
正极:发生还原反应的一极
5、根据电极反应的现象判断
负极:溶解或减轻的一极
正极:增重或放出气泡的一极
解:该装置没有外接电源,所以是原电池.原电池中,负极材料比正极材料活泼,且负极材料是随着反应的进行质量减少,正极质量增加或放出气泡.根据题意知,N极是负极,M是正极,且N极材料比M极活泼.
A、M极材料比N极活泼,故A错误;
B、M极上质量不增加,故B错误;
C、N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,故C正确;
D、M极材料比N极活泼,故D错误;
故选C.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
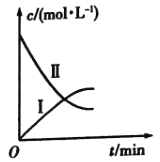
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 G 是一种黄烷酮类药物。下列说法正确的是
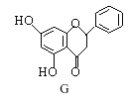
A.G分子中含有三种含氧官能团
B.G分子中含有2个手性碳原子
C.G可发生加成反应和水解反应
D.1 mol G与溴水反应,最多消耗2 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出具有下列分子式但仅有一个核磁共振信号的化合物的结构简式:
(1)C5H12_________________________;
(2)C3H6__________________________;
(3)C2H6O________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
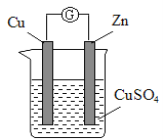
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00mL 0.1000mol·L1盐酸中滴加0.1000mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5,邻苯二甲酸为弱酸。下列说法不正确的是( )
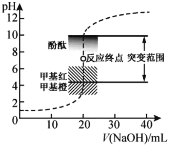
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用酸式滴定管量取20.00mL 0.1000mol·L1盐酸时,酸式滴定管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钠标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂废气中SO2的回收利用方案如图所示,下列说法不正确的是
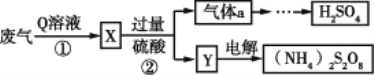
A.Q溶液是氨水
B.工业生产中气体a可通过两步反应转化为H2SO4
C.电解过程中被氧化的元素是硫
D.设计步骤①、②是为了富集SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式的书写及相关说法正确的是( )
A. CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ
B. C(s)+![]() O2(g)===CO(g) ΔH=-101.5 kJ·mol-1,该方程式的ΔH可表示碳的燃烧热
O2(g)===CO(g) ΔH=-101.5 kJ·mol-1,该方程式的ΔH可表示碳的燃烧热
C. 2 mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
D. Ba(OH)2(aq)+H2SO4(aq)===BaSO4(s)+2H2O(l) ΔH=-2a kJ·mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为-a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com