
【题目】根据要求,回答下列问题:
(1)写出离子反应方程式“Ba2+ + SO42- = BaSO4↓”对应的化学反应方程式____________;
(2)氧化还原反应“2Na + O2 ![]() Na2O2”,氧化产物是_______;氧化剂是_____。
Na2O2”,氧化产物是_______;氧化剂是_____。
(3)维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C 具有___。(填氧化性或还原性)
(4)某混合物中可能含有可溶性硫酸盐、碳酸盐及硝酸盐。为了检验其中是否含有硫酸盐,某同学取少量混合物溶于水后,向其中加入_________溶液,再加入______溶液发现有白色沉淀生成,并由此得出该混合物中含有硫酸盐的结论。
【答案】 Na2SO4+ BaCl2=2NaCl + BaSO4↓(其他合理答案均可); Na2O2 O2 还原性 稀盐酸 氯化钡
【解析】(1)可以用离子反应方程式“Ba2+ + SO42- = BaSO4↓”对应的化学反应方程式有Na2SO4 + BaCl2 =2NaCl + BaSO4↓等,故答案为:Na2SO4 + BaCl2 =2NaCl + BaSO4↓(其他合理答案均可);
(2)氧化还原反应“2Na + O2 ![]() Na2O2”中钠元素化合价升高,钠是还原剂,氧气是氧化剂,过氧化钠既是氧化产物,又是还原产物,故答案为:Na2O2;O2;
Na2O2”中钠元素化合价升高,钠是还原剂,氧气是氧化剂,过氧化钠既是氧化产物,又是还原产物,故答案为:Na2O2;O2;
(3)维生素C 能将Fe3+转变为易吸收的Fe2+,反应中铁元素的化合价降低,被还原,说明维生素C具有还原性,故答案为:还原性;
(4)某混合物中可能含有可溶性硫酸盐、碳酸盐及硝酸盐。为了检验其中是否含有硫酸盐,某同学取少量混合物溶于水后,向其中加入稀盐酸溶液,排除碳酸根离子的干扰,再加入氯化钡溶液发现有白色沉淀生成,说明混合物中含有硫酸盐,故答案为:稀盐酸;氯化钡。


科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是( ) 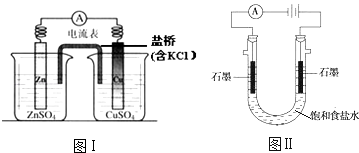
A.图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu
B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒
C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑
D.图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有反应:Cu2O+2H+=Cu+Cu2++H2O,则可用来检验氢气还原CuO所得的红色固体中是否含Cu2O的试剂是( )
A.稀硝酸B.稀硫酸C.盐酸D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。
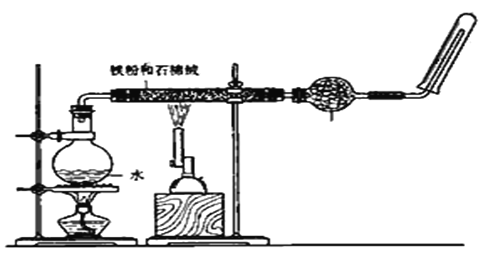
(1)写出该反应的化学方程式___________________________________________ ,四氧化三铁是_________________________(填“氧化产物”还是“还原产物”) 。
(2)加热烧瓶的作用是__________________________________________________。
(3)烧瓶底部放了几片碎瓷片,其作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A图是课本中“四种基本反应类型与氧化还原反应的关系”图,A图中用I~IV阴影部分表示反应所属的区域正确的是
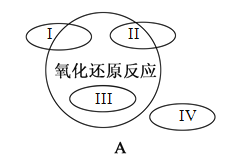
A. 粗硅提纯:Si(粗)+3HCl![]() SiHCl3+H2 所属区域可能是I或II
SiHCl3+H2 所属区域可能是I或II
B. 金属钠在空气中燃烧:2 Na + O2 ![]() Na2O2 所属的区域一定是III
Na2O2 所属的区域一定是III
C. 实验室制取氯气:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O所属的区域可能是III
MnCl2+Cl2↑+2H2O所属的区域可能是III
D. 土法制碱:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 所属的区域一定是IV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓硫酸的认识正确的是( )
A. 浓硫酸具有吸水性,可用来干燥H2S
B. 浓硫酸在常温下不与铁和铝反应
C. 可将蒸馏水注入浓硫酸进行稀释
D. 棉花接触浓硫酸后会变黑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.
(1)一定条件下,发生反应2SO2(g)+O2(g)2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的物质的量为1mol,则该可逆反应的平衡常数K=;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 0%(填“>”、“<”或“=”).
(2)在一密闭容器中发生反应2NO22NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示.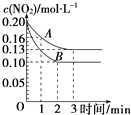
请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为 .
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是(填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)4NO2(g)+O2(g)
②2NO2(g)2NO(g)+O2(g)
若达平衡时,c(NO2)=0.4molL﹣1 , c(O2)=1.3molL﹣1 , 则反应②中NO2的转化率为 , N2O5(g)的起始浓度应不低于 molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.30 g乙烷中所含的极性共价键数为7NA
B.标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA
C.1 L浓度为1 molL﹣1的 H2O2水溶液中含有的氧原子数为2NA
D.MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣ ![]() 2PbSO4+2H2O则下列说法正确的是( )
2PbSO4+2H2O则下列说法正确的是( ) 
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣ ![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com