
【题目】进行下面的实验要用到下列一种仪器,请用这些仪器的名称填空。
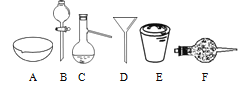
(1)欲干燥Cl2需使用仪器______;
(2)欲分离互不相溶的两种液体,可使用______;
(3)欲分离液态混合物中沸点不同的组分,可使用______;
(4)欲分离悬浮于液体中的固体物质,可使用______;
(5)欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用______。
(6)欲从食盐水中获得食盐晶体,可使用______。
【答案】干燥管 分液漏斗 蒸馏烧瓶 漏斗 坩埚 蒸发皿
【解析】
(1)干燥Cl2用无水氯化钙,无水氯化钙属于固体干燥剂,应该盛放在干燥管中,所以欲干燥Cl2需使用仪器为球形干燥管;
(2)分液漏斗用于分离互不相溶的两种液态物质,则欲分离互不相溶的两种液态物质,须使用分液漏斗;
(3)蒸馏烧瓶用于分离互溶的、沸点不同的液态混合物,则欲分离互溶的、沸点不同的液态混合物,须使用蒸馏烧瓶和酒精灯;
(4)漏斗用于分离不溶固体和液体混合物,欲分离悬浮于液体中的固体物质,可使用漏斗;
(5)加热固体,应在坩埚中进行,欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用坩埚。
(6)从含固体溶质的溶液中除去溶剂可用蒸发,欲从食盐水中获得食盐晶体,可使用蒸发皿。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】已知测定中和热的实验步骤如下:
![]() 量取50mL
量取50mL![]() 硫酸倒入小烧杯中,测量温度;
硫酸倒入小烧杯中,测量温度;
![]() 量取50mL
量取50mL![]() NaOH溶液,测量温度;
NaOH溶液,测量温度;
![]() 将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)![]() 溶液稍过量的原因______.
溶液稍过量的原因______.
(2)加入NaOH溶液的正确操作是______![]() 填字母
填字母![]() .
.
A.沿玻璃棒缓慢加入![]() 一次迅速加入
一次迅速加入![]() 分三次加入
分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______.
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
| NaOH | 平均值 | |||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
(4)设溶液的密度均为![]() ,中和后溶液的比热容
,中和后溶液的比热容![]() ,请根据实验数据求出中和热为______写出该反应的热化学方程式______
,请根据实验数据求出中和热为______写出该反应的热化学方程式______
(5)若将含![]()
![]() 的浓硫酸与含1molNaOH的溶液混合,放出的热量______
的浓硫酸与含1molNaOH的溶液混合,放出的热量______![]() 填“小于”、“等于”或“大于”
填“小于”、“等于”或“大于”![]() ,原因是______.
,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法正确的是( )
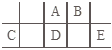
A.A的氢化物沸点比D的高,因为A的氢化物分子内存在氢键
B.工业上常用C与E形成的化合物来获得C的单质
C.简单离子的半径由大到小为:E>A>B>C
D.D、E两元素形成的化合物每种原子最外层一定都达到了8e-稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四个常用电化学装置的叙述中,正确的是![]()
![]()
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ氢氧燃料电池 |
A. 图Ⅰ所示电池中,MnO2是正极,电极反应式是2H2O+2e-=H2↑+2OH-
B. 图Ⅱ所示电池放电过程中,当外电路通过1mol电子时,理论上负极板的质量增加96g
C. 图Ⅲ所示装置工作过程中,阳极质量减少量等于阴极的质量增加量
D. 图Ⅳ所示电池中,不管KOH溶液换成H2SO4溶液还是Na2SO4溶液,电池的总反应式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:
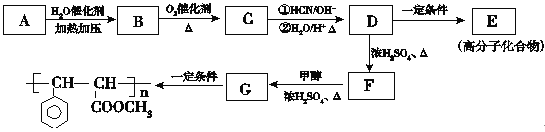
已知: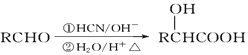
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出![]() 与足量氢氧化钠溶液反应的化学方程式________。
与足量氢氧化钠溶液反应的化学方程式________。
(8)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的叙述不正确的是( )。
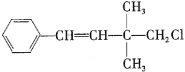
A.能使酸性![]() 溶液、溴水褪色,且原理相同
溶液、溴水褪色,且原理相同
B.![]() 该有机物能与
该有机物能与![]() 发生反应,最多消耗
发生反应,最多消耗![]() 的物质的量为
的物质的量为![]()
C.最多有10个碳原子共面
D.该有机物苯环上的一个![]() 被
被![]() 取代,有3种结构
取代,有3种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
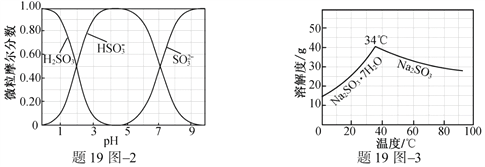
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2HI(g) ![]() H2(g)+I2(g)反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。
H2(g)+I2(g)反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。
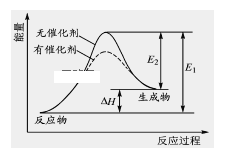
下列有关叙述正确的是 ( )
A.升高温度,反应速率增大,△H减小
B.升高温度,不影响活化分子百分数
C.逆反应的活化能等于正反应的活化能
D.催化剂能降低该反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇(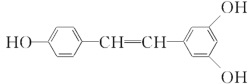 )广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
)广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
(1)关于它的说法正确的是________。
a.可使酸性KMnO4溶液褪色
b.可与FeCl3溶液作用显紫色
c.可使溴的CCl4溶液褪色
d.可与NH4HCO3溶液作用产生气泡
e.它属于醇类
(2)1 mol 该化合物最多消耗________ mol NaOH。
(3)1 mol 该化合物与Br2反应时,最多消耗________ mol Br2。
(4)1 mol该化合物与H2加成时,最多消耗标准状况下的H2的体积为________ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com