
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
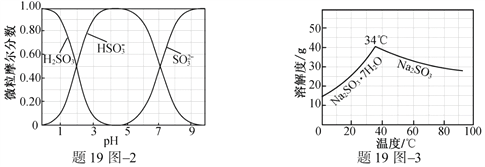
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
【答案】(15分)
(1)3Cl2+6OH![]() 5Cl+ClO3+3H2O 缓慢通入Cl2
5Cl+ClO3+3H2O 缓慢通入Cl2
(2)NaClO碱性溶液 减少水合肼的挥发
(3)①测量溶液的pH,若pH约为4,停止通SO2
②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
【解析】分析:步骤I中Cl2与NaOH溶液反应制备NaClO;步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,;步骤III分离出水合肼溶液;步骤IV由SO2与Na2CO3反应制备Na2SO3。
(1)温度超过40℃,Cl2与NaOH溶液发生歧化反应生成NaClO3、NaCl和H2O。由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率。
(2)步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性、能与NaClO剧烈反应生成N2,为了防止水合肼被氧化,应逐滴滴加NaClO碱性溶液。NaClO碱性溶液与尿素水溶液在110℃继续反应,N2H4·H2O沸点约118 ℃,使用冷凝管的目的:减少水合肼的挥发。
(3)①向Na2CO3溶液中通入SO2制备NaHSO3溶液,根据图示溶液pH约为4时,HSO3-的摩尔分数最大,则溶液的pH约为4时停止通入SO2。
②由NaHSO3溶液制备无水Na2SO3,首先要加入NaOH将NaHSO3转化为Na2SO3,根据含硫微粒与pH的关系控制pH;根据Na2SO3的溶解度曲线,确定分离Na2SO3的方法。
详解:(1)温度超过40℃,Cl2与NaOH溶液发生歧化反应生成NaClO3、NaCl和H2O,反应的化学方程式为3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,离子方程式为3Cl2+6OH-
5NaCl+NaClO3+3H2O,离子方程式为3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率;实验中控制温度除用冰水浴外,还需采取的措施是:缓慢通入Cl2。
5Cl-+ClO3-+3H2O。由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率;实验中控制温度除用冰水浴外,还需采取的措施是:缓慢通入Cl2。
(2)步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性、能与NaClO剧烈反应生成N2,为了防止水合肼被氧化,应逐滴滴加NaClO碱性溶液,所以通过滴液漏斗滴加的溶液是NaClO碱性溶液。NaClO碱性溶液与尿素水溶液在110℃继续反应,N2H4·H2O沸点约118 ℃,使用冷凝管的目的:减少水合肼的挥发。
(3)①向Na2CO3溶液中通入SO2制备NaHSO3溶液,根据图示溶液pH约为4时,HSO3-的摩尔分数最大,则溶液的pH约为4时停止通入SO2;实验中确定何时停止通入SO2的实验操作为:测量溶液的pH,若pH约为4,停止通SO2。
②由NaHSO3溶液制备无水Na2SO3,首先要加入NaOH将NaHSO3转化为Na2SO3,根据含硫微粒与pH的关系,加入NaOH应调节溶液的pH约为10;根据Na2SO3的溶解度曲线,温度高于34℃析出Na2SO3,低于34℃析出Na2SO3·7H2O,所以从Na2SO3溶液中获得无水Na2SO3应控制温度高于34℃。由NaHSO3溶液制备无水Na2SO3的实验方案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。


科目:高中化学 来源: 题型:
【题目】氮元素及其化合物的转化关系如下图所示:

回答下列问题:
(1)实验室常用下图装置制取并收集氨气,试管中发生反应的化学方程式是_____________。
(2)上图中的方框内收集氨气的装置是________(填下图中的字母)。
(3)用NH3制取NO的化学方程式是__________________。
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理,完成相应的化学方程式:2NO2+Na2CO3===NaNO2+________+________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体 (H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4 = CO2↑+CO↑+H2O 某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的 CO 气体,并用生成的 CO 气体还原 FexOy 制取铁粉。

(1)装置 B 的作用是_____。装置 E 中的现象是_________。装置 F 的作用是_________。
(2)装置 D 中玻璃管中发生反应的化学方程式为_____。
(3)若 FexOy 为 0.4g,生成的气体与过量澄清石灰水反应生成 0.75g 白色沉淀,则 FexOy 的化学式为_____。
(4)在实验开始时,点燃A、D 酒精灯的先后顺序是_____,实验完毕后,熄灭A、 D酒精灯的先后顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备直径为1---100 nm的颗粒Y(化合物),反应原理为:![]() a
a![]() 下列说法中不正确的是
下列说法中不正确的是
A.a=4 B.将Y均匀分散到水中形成的体系具有丁达尔效应
C. ![]() 是还原剂 D. 每有3 mol
是还原剂 D. 每有3 mol ![]() 参加反应,反应中转移的电子总数为5 mol
参加反应,反应中转移的电子总数为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,与酸反应产生还原性的硫化氢气体;焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是

A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的有
①17.6g丙烷中所含的共价健数为4 NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5 NA
③电解硫酸铜溶液,往电解后的溶液中加入氧化铜一定可以使溶液恢复到原来的状态
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤1.0L、pH=13的NaOH溶液中,OH-离子数目一定为0.1 NA
⑥将100mL、0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01 NA
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的电解实现了铜与杂质的分离,也造成了一部分资重金属进入阳极泥中,通过对阳极泥的综合处理可以回收可观的宝贵金属。稀散元素硒和碲广泛用于治金工业、电子工业、国防工业、医学和农业等领域,需求量越来越大。电解精炼铜的阳极泥主要成分为Cu2Se、Cu2Te和少量金属单质Au等,工业上从其中同收碲、硒的一种工艺流程如图:

已知:TeO2是两性氧化物,Se和TeO2的物理性质如下表:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)“焙烧”时所加的硫酸浓度最好为_____(填序号)。
a.10% b.50% c.70% d.98%
(2)加硫酸焙烧过程中Cu2Se参与反应的化学方程式为_________,氧化产物和还原产物的物质的量之比是_______。
(3)滤渣的主要成分是_______ (填化学式)。
(4)“酸溶”后,将TeO2先溶于盐酸得到四氯化碲,然后再通入二氧化硫得到碲单质,后者发生反应的化学方程式为______________ 。
(5)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致“沉碲”不完全,原因是______________ 。
(6)过滤所得粗硒中含有Ni、Fe、Cu等杂质,可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是_____(填序号)

a. 455℃ b.462℃ c.475℃ d.515℃
(7)工业上还可以通过电解铜阳极泥碱浸,过滤后的滤液得到单质碲。己知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在仪器①漏斗、②容量瓶、③蒸馏烧瓶、④分液漏斗、⑤烧杯、⑥蒸发皿 中,可用于粗盐提纯实验的有_____________________;可用于分离两种沸点接近且互不相溶的液态混合物实验的有_______________________。
(2)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
①将该粉末溶于水得无色溶液和白色沉淀。
②在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
③取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
该混合物中一定含有_______________;一定不含有___________________,可能含有__________________。
(3)正常人的血液中葡萄糖(简称血糖,分子式为C6H12O6)的浓度在3.61-6.11mmol/L之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于____mmol/L,血糖属正常、偏高还是偏低?________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是 ( )

A. 该反应的ΔH=+91 kJ·mol-1
B. 加入催化剂,该反应的ΔH变小
C. 反应物的总能量小于生成物的总能量
D. 如果该反应生成液态CH3OH,则ΔH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com