
【题目】氮元素及其化合物的转化关系如下图所示:

回答下列问题:
(1)实验室常用下图装置制取并收集氨气,试管中发生反应的化学方程式是_____________。
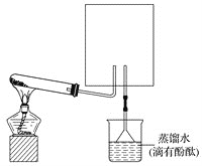
(2)上图中的方框内收集氨气的装置是________(填下图中的字母)。
(3)用NH3制取NO的化学方程式是__________________。
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理,完成相应的化学方程式:2NO2+Na2CO3===NaNO2+________+________,_______________
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ a 4NH3+5O2
CaCl2+2H2O+2NH3↑ a 4NH3+5O2![]() 4NO+6H2O NaNO3 CO2
4NO+6H2O NaNO3 CO2
【解析】
(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气与水;
(2)氨气的密度比空气小,应用向下排空气法收集;
(3)工业上利用氨气与氧气发生催化氧化生成NO与水;
(4)Na2CO3溶液进行尾气处理,可以得到NaNO2,根据电子转移守恒可知,二氧化氮还发生氧化反应,应生成硝酸,硝酸再与碳酸钠反应生成硝酸钠与二氧化碳,据此书写。
(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
(2)氨气的密度比空气小,应用向下排空气法收集,因此选a,故答案为:a。
(3)工业上利用氨气与氧气发生催化氧化制备NO,反应方程式为:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(4)Na2CO3溶液进行尾气处理,可以得到NaNO2,根据电子转移守恒可知,二氧化氮还发生氧化反应,应生成硝酸,硝酸再与碳酸钠反应生成硝酸钠与二氧化碳,反应总方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2,
故答案为:NaNO3,CO2。


科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃A在同温、同压下蒸气的密度是H:的43倍,其分子式为____分子中含102个氢原子的烷烃的分子式是_____
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__种。
(3)有机物 的正确命名为___________
的正确命名为___________
(4)立方烷 它的六氯代物有____种。
它的六氯代物有____种。
(5)  分子中最多有个____原子共面.
分子中最多有个____原子共面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A. 研制水溶剂涂料替代有机溶剂涂料
B. 用可降解塑料生产包装盒或快餐盒
C. 用反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O制备硫酸铜
CuSO4+SO2↑+2H2O制备硫酸铜
D. 用反应:2CH2=CH2+O2![]()
![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,可能生成2,2,3-三甲基戊烷的烃是( )
A. CH2 ==CHCH==C(CH3)2 B. CH2==CHC(CH3)2CH(CH3)2
C. (CH3)3C-CH=CH2 D. (CH3)3CC(CH3)==CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去下列物质中所含的杂质,所选用的试剂或操作方法错误的是( )
序号 | 物质 | 杂质 | 试剂或方法 |
A |
|
| 加热至恒重 |
B |
|
| 通入过量二氧化碳 |
C |
|
| 加入过量铜粉并过滤 |
D |
|
| 通入氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏伽德罗常数.下列说法正确的是( )
A. 标准状况下, 22.4LCCl4 中含有的分子数为 NA
B. 1 mol/L FeCl3 溶液中含有 3NA 个 Cl-
C. CO 和 N2组成的混合物 28g 共含有原子数为 2 NA
D. 0.5molKClO3中含有Cl-的数目为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________(填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
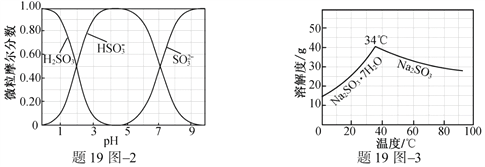
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com