
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________。
(2)第一电离能N______O(填“>”、“<”或“=”),其原因是_____________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
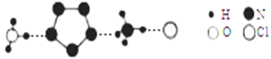
①R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________。
③图中虚线代表氢键,其表示式为(NH4+)NH…Cl、___________、____________。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
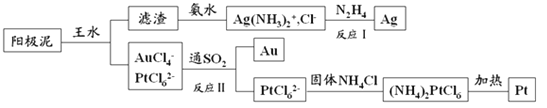
①滤渣的成分是_____________,(NH4)2PtCl6中配体是_______________________。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________,试写出该反应的化学方程式________。
【答案】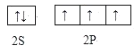 > N原子的2p轨道为半充满状态,具有一定稳定性,故第一电离能大 abd c 5
> N原子的2p轨道为半充满状态,具有一定稳定性,故第一电离能大 abd c 5 ![]() (H3O+)O-H…N (NH4+)N-H…N AgCl Cl- 王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水 Au + HNO3 + 4HCl ===H[AuCl4] + NO↑+ 2H2O
(H3O+)O-H…N (NH4+)N-H…N AgCl Cl- 王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水 Au + HNO3 + 4HCl ===H[AuCl4] + NO↑+ 2H2O
【解析】
(1)氮原子价层电子的电子排布式为2s22p3;
(2)N原子的2p轨道上有3个电子,为半充满结构,相对稳定;
(3)①根据图示,阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,孤电子对数为![]() =0,价层电子对数为2,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为
=0,价层电子对数为2,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为![]() =1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;
=1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;
②根据图示N5-中键总数为5个;
③O、N的非金属性较强,对应的O-H、N-H都可与H形成氢键;
(4)粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银,滤液中通入二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,过滤得到滤液中 含PtCl62-,加入固体氯化铵得到沉淀(NH4)2PtCl6,受热分解得到金属Pt。
(1)氮原子价层电子的电子排布式为2s22p3,则价层电子的轨道表达式为 ;
;
(2)N原子价层电子的电子排布式为2s22p3,而O原子价层电子的电子排布式为2s22p4,其中N原子的2p轨道为半充满状态,具有一定稳定性,故第一电离能N>O;
(3)①a.阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,孤电子对数为![]() =0,价层电子对数为4,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为
=0,价层电子对数为4,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为![]() =1,价层电子对数为4,为sp3杂化;
=1,价层电子对数为4,为sp3杂化;
b.由以上分析可知H3O+和NH4+中心原子的价层电子对数都为4;
c.NH4+为空间构型为正四面体,H3O+为空间构型为三角锥形;
d.含有的共价键类型都为σ键;
则:两种阳离子的相同之处为abd,不同之处为c;
②根据图示N5-中键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号![]() 表示;
表示;
③O、N的非金属性较强,对应的O-H、N-H都可与H形成氢键,还可表示为(H3O+)O-H…N、(NH4+)N-H…N;
(4)①粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,滤渣的成分是AgCl,(NH4)2PtCl6中配体是Cl-;
②金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO/span>2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;王水中硝酸的浓度降低,还原产物为NO,则生成H[AuCl4]时反应的化学方程式为Au + HNO3 + 4HCl ===H[AuCl4] + NO↑+ 2H2O。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】丙烯酸的结构简式是:CH2![]() CHCOOH。试写出它与下列物质反应的方程式。
CHCOOH。试写出它与下列物质反应的方程式。
(1)氢氧化钠溶液________________________________________。
(2)溴水________________________________________。
(3)乙醇________________________________________。
(4)氢气________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是

A. 单质①是最活泼的非金属单质
B. 单质②能使品红溶液褪色
C. 保存少量的单质③时加少量水进行水封
D. 单质④的氢化物在卤素氢化物中沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有关分子在催化剂作用下发生转化的示意图,下列叙述正确的是( )。
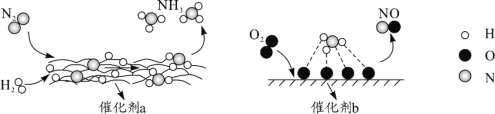
A.N2→NH3,NH3→NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是物质的量的单位,1mol任何物质都含有6.02×1023个分子
B.钠元素和氯元素在自然界存在的形态既有游离态又有化合态
C.气体的体积主要由气体物质的量的多少和气体分子间的平均距离决定的
D.若1克水中含有m个氢原子,则阿伏加德罗常数用含m的代数式可表示为18m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A.制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO ![]() Mg
Mg
B.冶炼铝:铝土矿![]() NaAlO2
NaAlO2 ![]() 无水 AlCl3
无水 AlCl3![]() Al
Al
C.制硝酸: N2、H2![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3![]() 浓 HNO3
浓 HNO3
D.海带![]() 海带灰
海带灰![]() I2(aq)
I2(aq) ![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.32 g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53 g KNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009 mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是
A.–3B.+4C.+3D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com