
| 156b |
| 22.4 |
| ||
| ag |
| 156b |
| 22.4a |
| 156b |
| 22.4a |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | C | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、1个 | B、2个 | C、3个 | D、4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
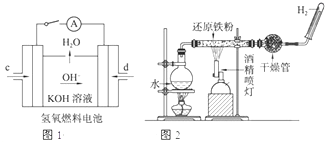 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
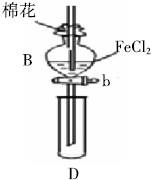 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
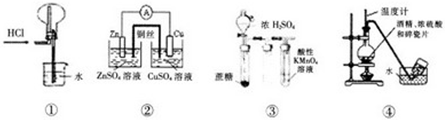
| A、实验①,氯化氢气体的吸收 |
| B、实验②,铜锌原电池 |
| C、实验③:酸性KMnO4溶液中出现气泡,且颜色不变 |
| D、实验④:实验室制取收集乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
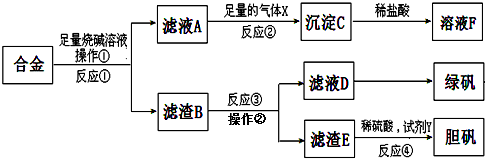
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
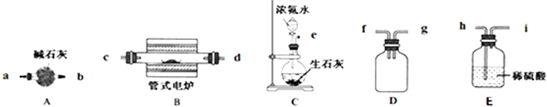
查看答案和解析>>
科目:高中化学 来源: 题型:
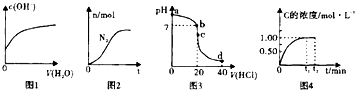
| A、图1表示亚硫酸氢钠溶液加水稀释时,溶液中c(OH-)的变化[已知亚硫酸氢钠溶液c(SO32-)>c(H2SO3)] |
| B、图2表示某离子反应中涉及Cl-,H+,N2,ClO-,NH4-,H2O六种微粒,其中N2的物质的量随时间变化的曲线,反应后溶液的酸性明显减弱 |
| C、图3表示室温下,将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线,d点所示溶中离子浓度由大到小的排序是c(Cl+)>c(NH4+)>c(H+)>c(OH+) |
| D、图4表示均为1molA,B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),C的浓度随时间变化的曲线,则x=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com