
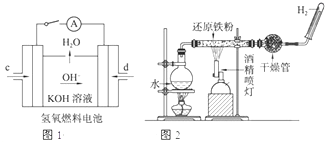
 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.| ①-② |
| 2 |
| 571.2KJ/mol-226.2KJ/mol |
| 2 |
| 1.92g |
| 64g/mol |
| 2 |
| 3 |
| 1.92g |
| 64g/mol |
| 0.448L |
| 22.4L/mol |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.
已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
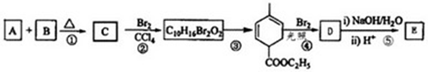
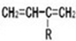 、CH2=CH2可以用键线式
、CH2=CH2可以用键线式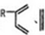 表示,两者可以发生如下反应:
表示,两者可以发生如下反应: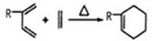 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5.请回答下列问题(用相应的元素符号、化学式和化学术语填空)
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5.请回答下列问题(用相应的元素符号、化学式和化学术语填空)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
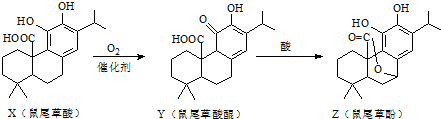
| A、X、Y、Z互为同分异构体 |
| B、X、Z均能与FeCl3溶液发生显色反应 |
| C、X、Y、Z分子中均含有2个手性碳原子 |
| D、1molX与NaOH溶液反应最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、刚玉的主要成分是二氧化硅,红宝石、蓝宝石是含少量不同金属氧化物的优质刚玉 |
| B、蛋白质水解后只生成一种纯净的物质--氨基酸 |
| C、所有金属及其化合物在火焰上灼烧,都会使火焰呈现特征颜色,即焰色反应 |
| D、生铁比纯铁易受腐蚀,减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com