
����Ŀ����1����.̫���ܡ����ܷ����õ��㷺Ӧ�ã��ڷ���ϵͳ�а�װ����װ�������ڳ����ȶ����磬�乹��ļ�ͼ����

����˵���У�����ȷ����________ (����ĸ���)
a��̫���ܡ����ܶ��������Դ
b��̫���ܵ����ʵ����̫���ܵ����ܵ�ת��
c������ϵͳ�ܹ����ƴ���ϵͳ�dz�绹�Ƿŵ�
d��������������ʱ������ϵͳʵ���ɻ�ѧ�ܵ����ܵ�ת��
��2��ȫ��Һ������Ǿ��з�չǰ���ġ���������ϵͳ�����ء���֪�ŵ�ʱV2+����������Ӧ����ŵ�ʱ�缫A�ĵ缫��ӦʽΪ________ ��
��3��������ˮ�����ˮ����Ⱦ���Ժ�����ˮ(��VO2+�⣬������Al3+�� Fe3+)�Ƚ����ۺϴ�����ʵ�ַ���Դ�Ļ������ã��������£�

��֪��ҺpH��Χ��ͬʱ�����Ĵ�����ʽ���±���ʾ
���Ļ��ϼ� | pH<2 | pH>11 |
+4�� | VO2+�� VO(OH)+ | VO(OH)3- |
+5�� | VO2+ | VO43- |
�ټ���NaOH������ҺpH��13ʱ������1������������ɻҰ�ɫת��Ϊ���ɫ���û�ѧ�����ʾ����NaOH���漰�������ﻹԭ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ________��
������Ե���Һ1(V�Ļ��ϼ�Ϊ+4)�м���H2O2��������________ ��
��4����.������ˮ�еĵ�Ԫ�ض���NH4+��NH3��H2O����ʽ���ڡ�ij��������������ˮ���������£�
![]()
���м���NaOH��Һ����pH=11��������������������ӷ���ʽ��ʾ��NaOH��Һ��������________���������������Ŀ����________��
��5�����м�������NaClO��Һ������pH��6~7��������ת��Ϊ�����ʣ����̢���3����Ӧ��
��.ClO-+H+=HClO
��.NH4++HClO=NH2Cl+H++H2O(NH2Cl��ClԪ��Ϊ+1��)
��. ����
��֪��ˮ������+1����ʽ���ڵ���Ԫ��������ɱ�������ã�����Ϊ������������ͼΪNaClO���������������������Ĺ�ϵʾ��ͼ�����а���������͵ĵ���c�㡣

b���ʾ����Һ�е�Ԫ�ص���Ҫ������ʽ��(�û�ѧʽ��ʾ) ________����Ӧ���Ļ�ѧ����ʽ��________��
��6��������Na2SO3��Һ���������ȷ�ˮ��Ҫ�����ˮ��ʣ��Na2SO3�ĺ���С��5mg��L-1���������ȷ�ˮ��NaClO�ĺ�����7.45mg��L-1������10m3�����ȷ�ˮ����������10%Na2SO3��Һ________kg(��Һ����仯���Բ���)��
���𰸡�d VO2++e-+2H+=VO2++H2O 4Fe(OH)2+2H2O+O2=4Fe(OH)3 2VO(OH)3-+H2O2+4OH-=2VO43-+6H2O NH4++OH-=NH3��H2O ��NH3���� NH2Cl 2NH2Cl+ HClO=N2+3HCl+H2O 1.31
��������
��1��a��̫���ܡ����ܶ����ڿ������������Դ��
b��̫���ܵ����ɽ�̫����ת��Ϊ���ܣ�
c������ϵͳ�ɿ��ƴ���ϵͳΪ���״̬�ͷŵ�״̬��
d��������������ʱ������ϵͳ��ʵ��̫���ܻ����ת��Ϊ���ܣ�
��2���ŵ�ʱV2+����������Ӧ����缫BΪ��������˵缫AΪ��������VO2+�����õ��ӵĻ�ԭ��Ӧ������VO2+��
��3���ٳ���1ΪFe(OH)2�������ɻҰ�ɫת��Ϊ���ɫ���γ���Fe(OH)3��
������H2O2���������ԣ��ܽ���Һ1�е�VO(OH)3-������VO43-��
��4������NaOH��Һ�������ˮ�е�NH4+��Ӧ�γ�NH3��H2O����������Ŀ����ɽ�NH3����Һ�д�����
��5��ab������Ҫ������Ӧ���ͷ�Ӧ��������NH2Cl��
bc����Ҫ������Ӧ������Һ��NH2Cl��HClO��Ӧ����N2��
��6�����ݷ�ˮ��NaClO�ĺ�����Na2SO3+NaClO=NaCl+Na2SO4����������n��Na2SO3�����ٽ�Ϸ�ˮ�д��������м��㡣
��1��a��̫���ܡ����ܶ����ڿ������������Դ�����������⣬a����
b��̫���ܵ����ɽ�̫����ת��Ϊ���ܣ����������⣬b����
c������ϵͳ�ɿ��ƴ���ϵͳΪ���״̬�ͷŵ�״̬�����������⣬c����
d��������������ʱ������ϵͳ��ʵ��̫���ܻ����ת��Ϊ���ܣ��������⣬d��ȷ��
��Ϊd��
��2���ŵ�ʱV2+����������Ӧ����缫BΪ��������˵缫AΪ��������VO2+�����õ��ӵĻ�ԭ��Ӧ������VO2+����˵缫A�ĵ缫��ӦʽΪ��VO2++e-+2H+=VO2++H2O��
��3���ٳ���1ΪFe(OH)2�������ɻҰ�ɫת��Ϊ���ɫ���γ���Fe(OH)3���䷴Ӧ�Ļ�ѧ����ʽΪ��4Fe(OH)2+2H2O+O2=4Fe(OH)3��
������H2O2���������ԣ��ܽ���Һ1�е�VO(OH)3-������VO43-����˸÷�Ӧ�Ļ�ѧ����ʽΪ��2VO(OH)3-+H2O2+4OH-=2VO43-+6H2O��
��4������NaOH��Һ�������ˮ�е�NH4+��Ӧ�γ�NH3��H2O���÷�Ӧ�����ӷ���ʽΪ��NH4++OH-=NH3��H2O����������Ŀ������ܽ���Һ���ܽ��NH3������
��5��ab������Ҫ������Ӧ���ͷ�Ӧ��������NH2Cl�����b����Һ�е�Ԫ�ص���Ҫ������̬ΪNH2Cl��
bc����Ҫ������Ӧ������Һ��NH2Cl��HClO��Ӧ����N2����ϵ�ʧ�����غ㡢ԭ���غ�ɵø÷�Ӧ�Ļ�ѧ����ʽΪ��2NH2Cl+HClO=N2+3HCl+H2O��
��6��10m3��ˮ��NaClO�ĺ���![]() ��Na2SO3��NaClO��Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+NaClO=NaCl+Na2SO4����˷�Ӧ����Na2SO3�����ʵ���ҲΪ1mol��������Ϊ��1mol��126g/mol=126g�����������Na2SO3��Һ������Ϊx����ɵ�
��Na2SO3��NaClO��Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+NaClO=NaCl+Na2SO4����˷�Ӧ����Na2SO3�����ʵ���ҲΪ1mol��������Ϊ��1mol��126g/mol=126g�����������Na2SO3��Һ������Ϊx����ɵ�![]() �����x=1310g=1.31kg��
�����x=1310g=1.31kg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA(s) + nB(g) eC(g) + fD(g)����Ӧ�����У���������������ʱ��C�İٷֺ���(C%)���¶�(T)��ѹǿ(P)�Ĺ�ϵ����ͼ��������������ȷ���� (����)
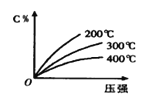
A.��ѧ����ʽ��n > e+f
B.�ﵽƽ��������£�ƽ������
C.��ƽ��������C%����
D.�ﵽƽ�������A������������ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������г�����һЩԭ�ӵ�2p�ܼ���3d�ܼ��е����Ų�����������ж���ЩΥ��������ԭ��__________����ЩΥ���˺��ع���__________��
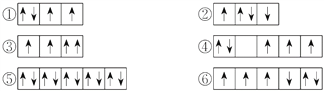
��2��ijԪ�صļ���̬(���ȶ�״̬)ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s13p33d2�����Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ__________��������������Ӧˮ����Ļ�ѧʽ��__________��
��3�������ж����ԭ�ӵ�ԭ�ӹ������������ɵ͵���˳�����С�
��2s������3d������4s������3s������4p������3p
��������ɵ͵�������˳����__________��
���𰸡� �� �ڢܢ� 1s22s22p63s23p4 H2SO4 �٢ܢޢۢڢ�
�������������������1����һ��ԭ�ӹ������ֻ������2�����ӣ��������ǵ�����״̬�෴����Ϊ����������ԭ�����������Ų���ͬһ���ܼ��IJ�ͬ���ʱ����̬ԭ���еĵ������ǵ�������ռ��һ���������������״̬��ͬ����Ϊ���ع�����(2)���ݼ���̬ԭ�Ӻ�������Ų�ʽ֪��Ԫ�غ�����16�����ӣ������������ԭ���������̬ԭ�Ӻ������������3����ͬ���Ӳ���ԭ�ӹ�������ĸߵͣ�ns��np��nd����״��ͬ��ԭ�ӹ�������ĸߵͣ�1s��2s��3s��4s������
��������1����һ��ԭ�ӹ������ֻ������2�����ӣ��������ǵ�����״̬�෴����Ϊ����������ԭ��������Υ������������ԭ�����Тۣ��������Ų���ͬһ���ܼ��IJ�ͬ���ʱ����̬ԭ���еĵ������ǵ�������ռ��һ���������������״̬��ͬ����Ϊ���ع�������Υ�����ع�����Тڢܢ���(2)���ݼ���̬ԭ�Ӻ�������Ų�ʽ֪��Ԫ�غ�����16�����ӣ�ΪSԪ�أ������������ԭ�������̬ԭ�Ӻ����������1s22s22p63s23p4��SԪ���������6�����ӣ����������+6��������������Ӧˮ����Ļ�ѧʽ��H2SO4����3����ͬ���Ӳ���ԭ�ӹ�������ĸߵͣ�ns��np��nd����״��ͬ��ԭ�ӹ�������ĸߵͣ�1s��2s��3s��4s�����������ԭ�ӵ�ԭ�ӹ������������ɵ͵���˳�����٢ܢޢۢڢݡ�
�����͡�������
��������
18
����Ŀ�����ֶ�����Ԫ��A��B��C��D�����ʻ�ṹ��Ϣ���¡�
��Ϣ��:ԭ�Ӱ뾶��С:A>B>C>D
��Ϣ��:����Ԫ��֮���γɵ�ij���ַ��ӵı���ģ�ͼ���������:
|
|
|
�ǵ��������������֮һ,����ΪҺ̬,�ǰ��������������������������Ҫ��Դ,Ҳ������������Ҫ����ɲ��� | ��ɫ,��ζ����ȼ,��21���͵���Ҫ��Դ | ����,��ǿ������,������������ɱ�� |
�����������Ϣ�ش��������⡣
��1���ס��ҡ����к��еĹ�ͬԪ���� (������)��
��2��BԪ�������ڱ��е�λ��Ϊ ��
��3������Ԫ�ص�ԭ��M����һ��δ�ɶ�p���ӵ��� (��Ԫ�ط���)��
��4�����ĵ���ʽΪ ,����SO2ˮ��Һ�ɷ���������ԭ��Ӧ,��������ǿ��,��ѧ��Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ��ݴ�����˵������ȷ����
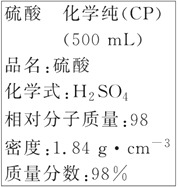
A.��װ����Ӧ���ϸ�ʴ��Һ���Σ��Ʒ��־ͼ��
B.1 mol Al�����������ᷴӦ����3 g����
C.����90 mL 4.6 mol��L��1��ϡ������ȡ������25 mL
D.����500 mL 4.6 mol��L��1��ϡ����ʱ������ʱ���ӿ̶��ߵ���Ũ��ƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CH4��CO2������H2O�γ���״�ṹ��ˮ���ᄃ�壬CH4��H2O�γɵ�ˮ�����׳�����ȼ������
��1������ȼ����������ƽ��ÿ46��H2O���ӹ���8����������6�����ֱ�����1��CH4���ӣ�����2�����ֱ�����1��H2O���ӣ�������ȼ����ƽ����ɿɱ�ʾΪ________(�ѧʽ)��
��2����֪��
CO2(g)+nH2O(l)=CO2��nH2O(s) ��H=-57.98kJ��moI-1
CH4(g)+nH2O(l)=CH4��nH2O(s) ��H=-54.49kJ��mol-1
��ӦCO2(g)+CH4��nH2O��s)=CH4��g)+CO2��nH2O(s)����H=________kJ��mol-1
��3����ѧ�������CO2���û���CH4���ɺ�������ȼ���������룬��������������������________��
��4��ͼ����ʾ��CO2��nH2O�������������Դ��� CH4��nH2O�ͷų������ʣ���ԭ����________��
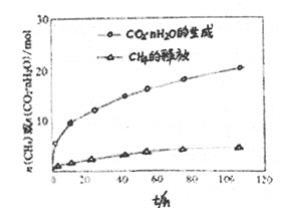
��5������CO2���������ԣ������˱������������Ʊ�ϩ���¹��ա��ù��տɲ��ø���������Ϊ�������䷴Ӧ������ͼ��
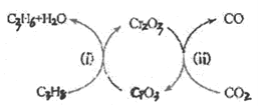
�ٷ�Ӧ(i)�Ļ�ѧ����ʽΪ________��
�ڸù��տ�����Ч������������Ļ�̿��ά�ִ������ԣ�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������500 mL 0.2 mol/L��Na2SO4��Һ��ʵ����������У�
A������ƽ�ϳƳ�14.2 g�����ƹ��壬���������ձ��У�������������ˮʹ����ȫ�ܽⲢ��ȴ�����¡�
B�����Ƶõ���ҺС�ĵ�ת�Ƶ�����ƿ�С�
C������������ƿ�м�����ˮ��Һ���̶���1-2 cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ����ʹ���̶������С�
D������������ˮϴ���ձ��Ͳ�����2-3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ע������ƿ����������
E��������ƿƿ�����������ҡ�ȣ�����д���пհף�
(1)�����������ȷ˳��Ϊ������ţ�_________��
(2)��ʵ���õ��Ļ������������ձ�����ƽ���̣������롢���ӣ�������������ȱ�ٵ�������_____��____��____��
(3)���������ʹ������ҺŨ��ƫ�ߵ��ǣ�����ţ�________��
a.ijͬѧ�۲�Һ����������ͼ��ʾ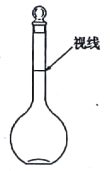
b��û���������IJ�������D
c��������ˮʱ�����������˿̶���
d��������մ������
e������ƿʹ��ǰ�ڱ�մ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL FeBr2��Һ����ͨ��C12������n(Fe3+)��n(Br2)��ͨ��n(Cl2)�ı仯��ͼ��ʾ������˵������ȷ����( )

A.������ǿ����Br2>Fe3+
B.��ͼ��֪����FeBr2��Һ��Ũ��Ϊ1molL��1
C.n(Cl2)= 0.12 molʱ����Һ�е�����Ũ����c(Fe3+):c(Br��)=1:8
D.c(FeBr2):c(Br2)= 1: 1ʱ����Ӧ�����ӷ���ʽ��2Fe3++2Br��+2Cl2=2Fe3++Br2+4Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�л���![]() ������������ȷ����( )
������������ȷ����( )
A. 1 mol���л��������3 mol Na������Ӧ
B. 1 mol���л��������3 mol NaOH������Ӧ
C. 1 mol���л��������6 mol H2�����ӳɷ�Ӧ
D. 1 mol���л���ֱ�������Na��NaHCO3��Ӧ����������������ͬ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�Ǻ�ˮ�к����϶�Ľ�����þ�Ͻ���þ�Ļ�������;�dz��㷺��
��1��Mg2Ni��һ�ִ���Ͻ���֪��
Mg��s��+H2��g��=MgH2��S�� ��H1=- 74��5kJ��mol-1
Mg2Ni��s��+2H2��g��=Mg2NiH4��s�� ��H2=- 64��4kJ��mol-l
��Mg2Ni��s��+2MgH2��s��=2Mg��s��+Mg2NiH4��s������H3=__________��
��2��ij����С����ˮ��þʯ����Ҫ�ɷ�ΪMgCl2��6H2O���Ʊ�����þ���յĹؼ��������£�

����С�齫MgCl2��6H2O����������н������ط������������ͼ��TG��ʾ������������ռԭ��Ʒ�������İٷ�������
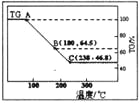
��ͼ��AB�߶�Ϊ��һ����ˮ������ȷ��B���Ӧ�������ʵĻ�ѧʽ_________________��ͼ��BC�߶�Ϊ��������ˮ������ʵ����ͨ��H2��Cl2ȼ�ղ����Ŀ����_______________��
���ù����У�����ѭ��ʹ�õ�������_____________��
��3��CH3MgCl��һ����Ҫ���л��ϳɼ�������þ�Ļ��ϼ���________________���û�����ˮ��ʱ���ɼ��顢�Ȼ�þ��������þ����д���÷�Ӧ�Ļ�ѧ����ʽ__________________��
��4���������Mg��AIH4��2��110��200���ķ�ӦΪ��Mg��AIH4��2��MgH2+2Al+3H2����ÿת��3 mol��������Al������Ϊ_______________��
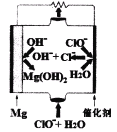
��5����þһ����������ȼ�ϵ�ص�װ������ͼ��ʾ���õ�ص�������ӦʽΪ_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com