
【题目】一定条件下,CH4和CO2都能与H2O形成笼状结构的水合物晶体,CH4与H2O形成的水合物俗称“可燃冰”。
(1)“可燃冰”晶体中平均每46个H2O分子构建8个笼,其中6个笼分别容纳1个CH4分子,另外2个笼分别容纳1个H2O分子,则“可燃冰”平均组成可表示为________(填化学式)。
(2)已知:
CO2(g)+nH2O(l)=CO2·nH2O(s) △H=-57.98kJ·moI-1
CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49kJ·mol-1
反应CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)的△H=________kJ·mol-1
(3)科学家提出用CO2“置换”CH4开采海底“可燃冰”的设想,提出该设想的理论依据是________。
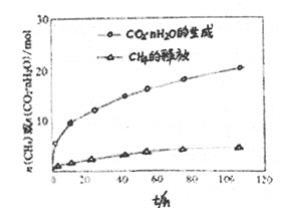
(4)图中显示,CO2·nH2O的生产速率明显大于 CH4·nH2O释放出的速率,其原因是________。
(5)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
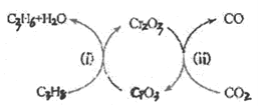
①反应(i)的化学方程式为________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是________。
【答案】CH4·8H2O -3.49 CO2置换 CH4.nH2O(s)的反应△H<0,在一定温度下可自发进行 CO2·nH2O除置换反应生成外,还存在CO2与H2O结生成CO2·nH2O的反应 3C3H8+2CrO3 3C3H6+Cr2O3+3H2O 碳与CO2反应生成CO,脱离催化剂表面
3C3H6+Cr2O3+3H2O 碳与CO2反应生成CO,脱离催化剂表面
【解析】
(1)根据“可燃冰”的晶体结构得到化学式;
(2)由盖斯定律计算;
(3)根据ΔG=ΔH-TΔS<0,反应可自发进行进行判断;
(5)①反应ⅰ中反应物为C3H8和CrO3,生成物为C3H6、H2O和Cr2O3;
②由于C能与CO2反应生成CO进行解释。
(1)由“可燃冰”的晶体结构可知,一个“可燃冰”晶体结构中含有6个CH4分子和48个H2O分子,因此其平均组成可表示是为CH4·8H2O;
(2)由盖斯定律可得,反应“CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)”的反应热ΔH=(-57.98kJ/mol)-(-54.94kJ/mol)=-3.49kJ/mol;
(3)由于该反应的ΔH<0,因此在一定条件下,可满足ΔH-TΔS<0,反应可自发进行,因此可用CO2置换CH4开采海底“可燃冰”;
(4)由于CO2能与H2O反应生成CO2·nH2O,因此CO2·nH2O的生成速率明显大于CH4·nH2O的释放速率;
(5)①由反应机理图可知,反应ⅰ中反应物为C3H8和CrO3,生成物为C3H6、H2O和Cr2O3,因此该反应的化学方程式为:3C3H8+2CrO3=3C3H6+Cr2O3+3H2O;
②由于C能与CO2反应生成CO,因此该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) ![]() 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
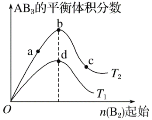
A. 若T2<T1,则正反应一定是放热反应
B. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
C. 达到平衡时A2的转化率大小为b>a>c
D. 若T2<T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO2、O2和熔融NaNO3组成的燃料电池如图所示。在该电池工作过程中石墨Ⅰ电极产生一种气态氧化物Y。下列说法正确的是( )

A.Y可能为NO B.电流由石墨Ⅰ流向负载
C.石墨Ⅰ上发生还原反应 D.石墨Ⅱ上的电极反应:O2+2N2O5+4e-=4NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为d g·cm-3的溶液V mL含有摩尔质量为M的溶质m g,其物质的量浓度为c mo/L,质量分数为W%,下列表示式不正确的是
A.W%=![]() %B.d=
%B.d=![]() C.c=
C.c=![]() D.m=
D.m=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ca(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述正确的是

A.D~E段沉淀减少的反应方程式是:CaCO3 + CO2 + H2O = Ca(HCO3)2
B.A~B段与C~D段发生反应的离子方程式都是:CO32- + CO2+H2O =2HCO3-
C.B~C段反应的离子方程式是:Ca(OH)2+CO2=CaCO3↓+H2O
D.O~A段反应的化方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Ⅰ.太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下

下列说法中,不正确的是________ (填字母序号)
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A的电极反应式为________ 。
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+, Fe3+)等进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH范围不同时,钒的存在形式如下表所示
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+, VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后涉及到氧化物还原反应的化学反应方程式为________。
②向碱性的滤液1(V的化合价为+4)中加入H2O2的作用是________ 。
(4)Ⅱ.氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
Ⅰ中加入NaOH溶液,调pH=11并鼓入大量空气,用离子方程式表示加NaOH溶液的作用是________;鼓入大量空气的目的是________。
(5)Ⅱ中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质,过程Ⅱ发生3个反应:
ⅰ.ClO-+H+=HClO
ⅱ.NH4++HClO=NH2Cl+H++H2O(NH2Cl中Cl元素为+1价)
ⅲ. ……
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”。下图为NaClO加入量与“余氯”含量的关系示意图。其中氨氮含量最低的点是c点。

b点表示的溶液中氮元素的主要存在形式是(用化学式表示) ________;反应ⅲ的化学方程式是________。
(6)Ⅲ中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg·L-1。若含余氯废水中NaClO的含量是7.45mg·L-1,则处理10m3含余氯废水,至多添加10%Na2SO3溶液________kg(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)又叫乙二酸,广泛存在于植物源食品中,25℃时,其解离常数Kal=5.9×10-2; Ka2= 6.4×10-5。下列与草酸有关的说法错误的是
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) △H >0;升温有利于提高草酸的电离程度
B.草酸中的碳为+3价,具有较强的还原性,可使酸性高锰酸钾溶液褪色
C.25℃时,KHC2O4溶液呈弱酸性,有时用于清洗金属表面的锈迹
D.同浓度的KHC2O4和K2C2O4混合溶液中:2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期p区元素多为非金属元素
(1)基态磷原子的价层电子排布图是__________,第三周期元素中,第一电离能最大的前三种元素是__________________。
(2)BF3、NF3、PCl3、SCl2四种分子中,属于平面三角形的是____________,中心原子杂化类型为sp3的是_______________。
(3)已知H2O的沸点比H2O2低58℃但比H2S高160℃,导致这种差异的原因是________________。
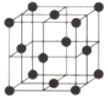
(4)金属铝的晶胞结构如图,若晶胞参数r pm,则单质的密度为(用NA表示阿伏加德罗常数)_______________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
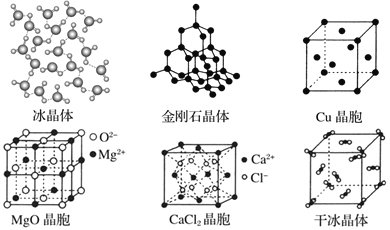
请回答下列问题:
(1)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____。
(2)MgO晶体中,距每个O2-最近且距离相等的O2-有_____个。
(3)每个Cu晶胞中实际占有_____个Cu原子;CaCl2晶体中Ca2+的配位数为_____。
(4)冰的熔点远高于干冰,除 H2O 是极性分子、CO2 是非极性分子外, 还有一个重要的原因是____。
(5)金刚石晶胞含有_________个碳原子;若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率_____(计算结果为含π的分数,不要化为小数或百分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com