
����Ŀ������(H2C2O4)�ֽ��Ҷ��ᣬ�㷺������ֲ��ԴʳƷ�У�25��ʱ������볣��Kal=5.9��10-2�� Ka2= 6.4��10-5������������йص�˵���������
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) ��H >0��������������߲���ĵ���̶�
B.�����е�̼Ϊ+3�ۣ����н�ǿ�Ļ�ԭ�ԣ���ʹ���Ը��������Һ��ɫ
C.25��ʱ��KHC2O4��Һ�������ԣ���ʱ������ϴ����������⼣
D.ͬŨ�ȵ�KHC2O4��K2C2O4�����Һ�У�2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
���𰸡�D
��������
A�������¶ȣ�����ƽ��������У���������߲���ĵ���ȣ�Aѡ����ȷ��
B����������Ԫ��Ϊ+1�ۣ���Ԫ��Ϊ-2�ۣ�����̼Ԫ��Ϊ+3�ۣ����н�ǿ�Ļ�ԭ�ԣ������������ط�Ӧʹ����ɫ��Bѡ����ȷ��
C��25��ʱ��HC2O4-��ˮ��ƽ�ⳣ��Kh=![]() =
=![]() =1.7��10-13< Ka2����������ĵ���̶ȴ���ˮ��̶ȣ�������������ԣ�����������ϴ����������⼣��Cѡ����ȷ��
=1.7��10-13< Ka2����������ĵ���̶ȴ���ˮ��̶ȣ�������������ԣ�����������ϴ����������⼣��Cѡ����ȷ��
D�����������غ��У�ͬŨ�ȵ�KHC2O4��K2C2O4�����Һ�У�3c(H2C2O4)+3c(HC2O4)+3c(C2O42-)=2c(K+)��Dѡ�����
��ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������pH��Ϊ3��HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpHֵ�ı仯����ͼ��ʾ������˵����ȷ���ǣ� ��
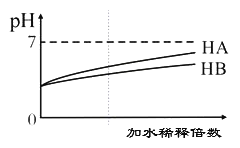
A. ��HB��Һ�еμ�NaOH��Һ�Ĺ����У�ˮ�ĵ���̶�һֱ����
B. ��pHΪ11��ij����pHΪ3��HB��Һ�������Ϻ���Һ�������Լ���
C. ��ˮ��HA��Һ��Ϻ����Һ�п��ܴ��ڣ�c(NH4�� )>c(A��)>c(H��)>c(OH��)
D. ��ȫ�к͵������pH��HA��HB����Һʱ������ͬŨ��NaOH��Һ�������HA<HB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�Ļ��������п��ܺ���NO2��NO��CO2��O2��NH3��N2�еļ��֣���100mL�����徭����ͼ��ʾ��ʵ��װ�ý��д���������õ�������Һ��������������ʣ�࣬�����������Ϊ(������Na2O2��NO2��NO�ķ�Ӧ)�� ��
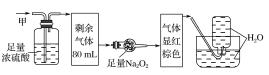
A.NO2��CO2��N2B.NH3��NO��CO2
C.NH3��N2��CO2D.NO��O2��NH3
���𰸡�B
��������
��������ɫ��˵�����в���NO2������ͨ��Ũ���������С��˵��������NH3������ͨ������Na2O2���Ժ���ɫ��˵�����к���CO2��NO���ʲ���O2�����ͨ��ˮ��������ʣ�࣬˵�����в�����N2��ѡ��B��ȷ���ʴ�ΪB��
�����͡���ѡ��
��������
19
����Ŀ��A��B��C��D�����ֳ������嵥�ʡ�E����Է���������FС16����FΪ����ɫ���йص�ת����ϵ��ͼ��ʾ(��Ӧ�����벿�ַ�Ӧ����������ȥ)��
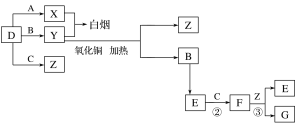
��ش��������⣺
��1��D�Ļ�ѧʽΪ__��Y�Ļ�ѧʽΪ__��E�Ļ�ѧʽΪ__��
��2��Y������ͭ��Ӧ��ÿ����1molB����3mol����ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��3��Y��E��һ�������¿ɷ�Ӧ����B��Z������һ������ʵ������ķ�Ӧ��������E�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
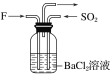
��4������F������SO2��ͨ��������ͬʱͨ��ʢ��BaCl2��Һ��ϴ��ƿ��(��ͼ��ʾ)��ϴ��ƿ���Ƿ��г������ɣ�__��������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�CH4��CO2������H2O�γ���״�ṹ��ˮ���ᄃ�壬CH4��H2O�γɵ�ˮ�����׳�����ȼ������
��1������ȼ����������ƽ��ÿ46��H2O���ӹ���8����������6�����ֱ�����1��CH4���ӣ�����2�����ֱ�����1��H2O���ӣ�������ȼ����ƽ����ɿɱ�ʾΪ________(�ѧʽ)��
��2����֪��
CO2(g)+nH2O(l)=CO2��nH2O(s) ��H=-57.98kJ��moI-1
CH4(g)+nH2O(l)=CH4��nH2O(s) ��H=-54.49kJ��mol-1
��ӦCO2(g)+CH4��nH2O��s)=CH4��g)+CO2��nH2O(s)����H=________kJ��mol-1
��3����ѧ�������CO2���û���CH4���ɺ�������ȼ���������룬��������������������________��
��4��ͼ����ʾ��CO2��nH2O�������������Դ��� CH4��nH2O�ͷų������ʣ���ԭ����________��
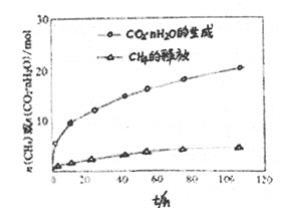
��5������CO2���������ԣ������˱������������Ʊ�ϩ���¹��ա��ù��տɲ��ø���������Ϊ�������䷴Ӧ������ͼ��
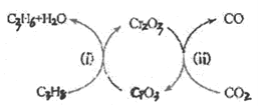
�ٷ�Ӧ(i)�Ļ�ѧ����ʽΪ________��
�ڸù��տ�����Ч������������Ļ�̿��ά�ִ������ԣ�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���о����ᱻ��������������������ʵ�顣
��1���о����ᱻMnO2������
ʵ�� | ���� | ���� |
�� | �����½�MnO2��12mol��L-1Ũ������ | ��Һ��dz��ɫ���д̼�����ζ |
�� | �����л������ˣ�������Һ | ���ɴ�������ɫ���� |
�� | ����MnO2��4mol��L-1ϡ�������� | ���������� |
����֪MnO2�������ԡ�������Һ��dz��ɫ������MnO2��Ũ���ᷢ���˸��ֽⷴӦ����ѧ������________ ��
�ڢ��з����˷ֽⷴӦ����Ӧ�Ļ�ѧ����ʽ��________ ��
�ۢ��������������ԭ������c(H+)��c(Cl-)�ϵͣ����ʵ�������̽����

��ʵ������Աȣ��ó��Ľ�����________��
������ͼװ��(a��b��Ϊʯī�缫)����ʵ��V��

i. K�պ�ʱ��ָ������ƫת
��. ���ҹ��еμ�ŨH2SO4��c(H+)��7mol��L-1��ָ��ƫת���ȱ仯������������еμ�ŨH2SO4��c��H+)��7mol��L-1��ָ������ƫת��������
��i�͢��������Աȣ��ó��Ľ�����________��
��2���о������ܷ���������������
����ƿ�з���ŨH2SO4��ͨ����Һ©������ƿ�еμ�Ũ���ᣬ��ƿ�Ϸ�����������������ʪ��ĵ���KI��ֽ���飬�����������ɴ˵ó�Ũ����________(������������������)�������ᡣ
�����Թ��м���3mLŨ���ᣬ�ټ���1mLŨHNO3���Թ���Һ����Ϊ��ɫ�����ȣ������ػ�ɫ���壬�����麬��NO2��
ʵ�� | ���� | ���� |
�� | ��ʪ��ĵ���KI��ֽ�����ػ�ɫ������ | ��ֽ�ȱ���������ɫ |
�� | ��ʪ��ĵ���KI��ֽ���봿��Cl2�� | ��ֽ�ȱ���������ɫ |
�� | ���� | ���� |
ͨ��ʵ���֤����������к���Cl2����IJ�����________��
��3��������ʵ��ó��������ܷ������������������ࡢ________�йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL FeBr2��Һ����ͨ��C12������n(Fe3+)��n(Br2)��ͨ��n(Cl2)�ı仯��ͼ��ʾ������˵������ȷ����( )

A.������ǿ����Br2>Fe3+
B.��ͼ��֪����FeBr2��Һ��Ũ��Ϊ1molL��1
C.n(Cl2)= 0.12 molʱ����Һ�е�����Ũ����c(Fe3+):c(Br��)=1:8
D.c(FeBr2):c(Br2)= 1: 1ʱ����Ӧ�����ӷ���ʽ��2Fe3++2Br��+2Cl2=2Fe3++Br2+4Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ(![]() )������һ������ĭ���еľ۱���ϩ�ĵ��壬��ϳ����漰���ķ�Ӧ���£�
)������һ������ĭ���еľ۱���ϩ�ĵ��壬��ϳ����漰���ķ�Ӧ���£�
I.CO2��g��+H2��g��CO��g��+H2O��g����H1
��.![]() (g)
(g) ![]() (g)+H2(g) ��H2
(g)+H2(g) ��H2
��. ![]() (g)+CO2(g)
(g)+CO2(g) ![]()
![]() (g)+CO(g)+H2O(g) ��H3
(g)+CO(g)+H2O(g) ��H3
(1)T��ʱ��2L�ܱ������н��еķ�Ӧ��������Ͷ�Ϸ�ʽ�ٽ���Ͷ�ϣ�15 min��Ӧ�ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����0~15 min��ƽ����Ӧ������( H2)= ________������Ͷ�Ϸ�ʽ�ڽ���Ͷ�ϣ���ʼ��Ӧ��������(H2) ______����(H2)������>����<������=������
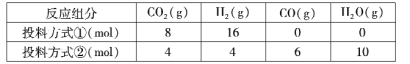
(2)����H2=____________���ú�����H1����H3��ʽ�ӱ����
(3)�о��������¶ȡ�ѹǿ�Է�Ӧ�����ұ�ƽ��ת���ʵ�Ӱ����ͼ��ʾ��

����H3 ______0������>����<������=������P1��P2��P3�Ӵ�С��˳���� __________ ��
(4)���˸ı��¶Ⱥ�ѹǿ�����ṩ����һ�ֿ�����߱���ϩ���ʵķ���__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ���ǣ� ��
A.��״���£�22.4L�������еķ�����ΪNA
B.1mol�ǻ��к��еĵ�����Ϊ10NA
C.14g C2H4��C3H6������庬�е�ԭ����Ϊ3NA
D.1L0.1mol/L�Ĵ�����Һ�к���H+����Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�鰴����ʵ������̽�������е����ȡ��
ʵ��(һ)

ʵ��(��) ���ƺ�����ȡԭҺ���ס�������ʵ�鷽�����£�

��֪��3I2��6NaOH��5NaI��NaIO3��3H2O��
��ش�
��1������X��ʵ���������Ϊ_________�����õ�����Ҫ������________��
��2�������йز���Y��˵������ȷ����_______________��
A��Ӧ����NaOH��Һ��Ũ�Ⱥ���� B������ת�������ӽ���ˮ��
C����Ҫʵ�����Ϊ���� D��NaOH��Һ�������Ҵ�����
��3������Z�м�����H2SO4��Һ����д��������Ӧ�����ӷ���ʽ_________________��
��4��ʵ��(��) �в���W��������________________��
��5�������������������������__________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com