
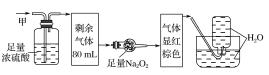
����Ŀ��ij��ɫ�Ļ��������п��ܺ���NO2��NO��CO2��O2��NH3��N2�еļ��֣���100mL�����徭����ͼ��ʾ��ʵ��װ�ý��д���������õ�������Һ��������������ʣ�࣬�����������Ϊ(������Na2O2��NO2��NO�ķ�Ӧ)�� ��
A.NO2��CO2��N2B.NH3��NO��CO2
C.NH3��N2��CO2D.NO��O2��NH3
���𰸡�B
��������
��������ɫ��˵�����в���NO2������ͨ��Ũ���������С��˵��������NH3������ͨ������Na2O2���Ժ���ɫ��˵�����к���CO2��NO���ʲ���O2�����ͨ��ˮ��������ʣ�࣬˵�����в�����N2��ѡ��B��ȷ���ʴ�ΪB��
�����͡���ѡ��
��������
19
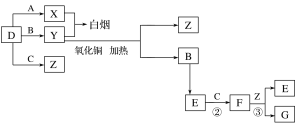
����Ŀ��A��B��C��D�����ֳ������嵥�ʡ�E����Է���������FС16����FΪ����ɫ���йص�ת����ϵ��ͼ��ʾ(��Ӧ�����벿�ַ�Ӧ����������ȥ)��
��ش��������⣺
��1��D�Ļ�ѧʽΪ__��Y�Ļ�ѧʽΪ__��E�Ļ�ѧʽΪ__��
��2��Y������ͭ��Ӧ��ÿ����1molB����3mol����ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��3��Y��E��һ�������¿ɷ�Ӧ����B��Z������һ������ʵ������ķ�Ӧ��������E�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
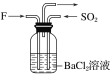
��4������F������SO2��ͨ��������ͬʱͨ��ʢ��BaCl2��Һ��ϴ��ƿ��(��ͼ��ʾ)��ϴ��ƿ���Ƿ��г������ɣ�__��������__��
���𰸡�H2 NH3 NO 2NH3��3CuO![]() N2��3Cu��3H2O 6NO��4NH3
N2��3Cu��3H2O 6NO��4NH3![]() 5N2��6H2O �� ����������ˮ��Ӧ�������ᣬ����ɽ�������������������������ᣬ�������Ȼ�����Ӧ���������ᱵ����
5N2��6H2O �� ����������ˮ��Ӧ�������ᣬ����ɽ�������������������������ᣬ�������Ȼ�����Ӧ���������ᱵ����
��������
A��B��C��D�����ֳ������嵥�ʣ�E����Է�������F��С16����FΪ����ɫ������֪FΪNO2��EΪNO��CΪO2��BΪN2�����ת����ϵ�����嵥��D��A��Ӧ�õ�X�����嵥��D��B��Ӧ�õ�Y��X��Y��Ӧð���̣�Ӧ�ǰ�����HCl��Ӧ������֪DΪ������AΪ������XΪHCl��YΪ������D��C��Ӧ����ZΪˮ��F��Z��Ӧ����GΪHNO3���ݴ˽��
A��B��C��D�����ֳ������嵥�ʣ�E����Է�������F��С16����FΪ����ɫ������֪FΪNO2��EΪNO��CΪO2��BΪN2�����ת����ϵ�����嵥��D��A��Ӧ�õ�X�����嵥��D��B��Ӧ�õ�Y��X��Y��Ӧð���̣�Ӧ�ǰ�����HCl��Ӧ������֪DΪ������AΪ������XΪHCl��YΪ������D��C��Ӧ����ZΪˮ��F��Z��Ӧ����GΪHNO3��
(1)������������֪��D�Ļ�ѧʽΪH2��Y�Ļ�ѧʽΪNH3��E�Ļ�ѧʽΪNO��
(2)NH3������ͭ��Ӧ��ÿ����1molN2����3mol����ͭ����ԭ������CuӦ�ǻ��ϼ�Ϊa����3(2-a)=2��3�����a=0��������Cu���÷�Ӧ�Ļ�ѧ����ʽΪ��2NH3+3CuO ![]() N2+3Cu+3H2O��
N2+3Cu+3H2O��
(3)Y��E��һ�������¿ɷ�Ӧ����B��Z������һ������ʵ������ķ�Ӧ��������E�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO ![]() 5N2+6H2O��
5N2+6H2O��
(4)����������ˮ��Ӧ�������ᣬ����ɽ�������������������������ᣬ�������Ȼ�����Ӧ���������ᱵ������������NO2������SO2��ͨ��������ͬʱͨ��ʢ��BaCl2��Һ��ϴ��ƿ�У�ϴƿ���г������ɡ�


 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ü�������NO2��Ⱦ�����о���CH4+2NO2![]() N2+CO2+2H2O����1L�ܱ������У����Ʋ�ͬ�¶ȣ��ֱ����0.50molCH4��1.2molNO2�����n(CH4)��ʱ��仯���й�ʵ�����ݼ�����
N2+CO2+2H2O����1L�ܱ������У����Ʋ�ͬ�¶ȣ��ֱ����0.50molCH4��1.2molNO2�����n(CH4)��ʱ��仯���й�ʵ�����ݼ�����
��� | �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
�� | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
�� | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | �� | 0.15 |
����˵����ȷ���ǣ� ��
A. �����У�0~20min�ڣ�NO2�Ľ�������Ϊ0.0125mol��L-1��min-1
B. ��ʵ�����ݿ�֪�÷�Ӧ�����˵��¶�ΪT1
C. 40minʱ��������T2Ӧ�������Ϊ0.18
D. 0��10min�ڣ�CH4�Ľ������ʢ�>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
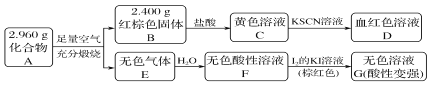
����Ŀ�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ����̽������ɣ�
��ش�
��1��A�����Ԫ��Ϊ________(��Ԫ�ط��ű�ʾ)����ѧʽΪ_____________________��
��2����ҺC���ܽ�ͭƬ�����ٸ÷�Ӧ��һ��ʵ��Ӧ��________��
��3����֪������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ������(����µ��ܶ�Ϊ1.518 g��L��1)����������ӵĵ���ʽΪ________��д���÷�Ӧ�����ӷ���ʽ____________________��
д��F��G��Ӧ�Ļ�ѧ����ʽ___________________________________��
���ʵ�鷽��̽����ҺG�е���Ҫ��(������H2O��H����K����I��) _____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NO2��O2������NaNO3��ɵ�ȼ�ϵ����ͼ��ʾ���ڸõ�ع���������ʯī��缫����һ����̬������Y������˵����ȷ����( )

A.Y����ΪNO B.������ʯī��������
C.ʯī���Ϸ�����ԭ��Ӧ D.ʯī���ϵĵ缫��Ӧ��O2+2N2O5+4e-=4NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��þ����Ҫ�������£�����˵����ȷ����

���Լ�M������ �������еķ�Ӧȫ�����Ƿ�������ԭ��Ӧ
�۲���bֻ�ǹ��� ���ú�ˮɹ�κ�ı�����Һ��ʯ������Mg(OH)2
�ݲ��õ�ⷨұ��þ����Ϊþ�ܻ���
A. �٢ڢۢܢ� B. �ڢ� C. �ܢ� D. �٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܶ�Ϊd g��cm��3����ҺV mL����Ħ������ΪM������m g�������ʵ���Ũ��Ϊc mo/L����������ΪW%�����б�ʾʽ����ȷ����
A.W%��![]() %B.d��
%B.d��![]() C.c��
C.c��![]() D.m��
D.m��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2���建����ͨ�뵽��KOH��Ca(OH)2��KAlO2�Ļ����Һ��ֱ�����������ɳ��������ʵ�������ͨCO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����еĸ���������ȷ����

A.D��E�γ������ٵķ�Ӧ����ʽ�ǣ�CaCO3 + CO2 + H2O = Ca(HCO3)2
B.A��B����C��D�η�����Ӧ�����ӷ���ʽ���ǣ�CO32- + CO2+H2O =2HCO3-
C.B��C�η�Ӧ�����ӷ���ʽ�ǣ�Ca(OH)2��CO2=CaCO3����H2O
D.O��A�η�Ӧ�Ļ�����ʽ�ǣ�2AlO2-��3H2O��CO2=2Al(OH)3����CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)�ֽ��Ҷ��ᣬ�㷺������ֲ��ԴʳƷ�У�25��ʱ������볣��Kal=5.9��10-2�� Ka2= 6.4��10-5������������йص�˵���������
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) ��H >0��������������߲���ĵ���̶�
B.�����е�̼Ϊ+3�ۣ����н�ǿ�Ļ�ԭ�ԣ���ʹ���Ը��������Һ��ɫ
C.25��ʱ��KHC2O4��Һ�������ԣ���ʱ������ϴ����������⼣
D.ͬŨ�ȵ�KHC2O4��K2C2O4�����Һ�У�2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ṹ��ʽ��ͼ�����й��ڸ��л����˵����ȷ���ǣ� ��
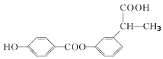
A.1 mol ���л�������� 3 mol NaOHB.���л���ķ���ʽΪ C16H17O5
C.������ 8 mol H2 �����ӳ�D.�����ϵ�һ������� 6 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com