
【题目】密度为d g·cm-3的溶液V mL含有摩尔质量为M的溶质m g,其物质的量浓度为c mo/L,质量分数为W%,下列表示式不正确的是
A.W%=![]() %B.d=
%B.d=![]() C.c=
C.c=![]() D.m=
D.m=![]()
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①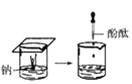 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②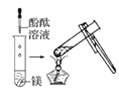 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③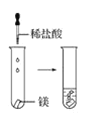 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④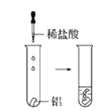 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是 __________________;
②确定分子式:如图是该有机物的质谱图,则其相对分子质量为 ____;分子式为 _____;

③结构式的确定:经测定,该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6∶1∶2∶1;该有机物与金属钠反应产生氢气;则A的结构简式为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
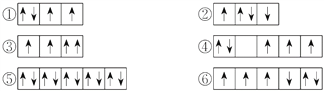
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】试题分析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
解析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。
【题型】综合题
【结束】
18
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
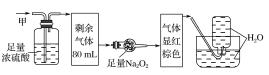
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
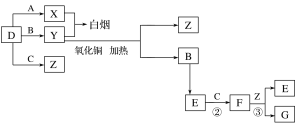
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
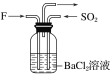
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法不正确的是
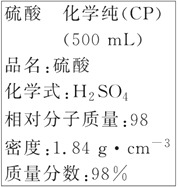
A.包装箱上应贴上腐蚀性液体的危险品标志图标
B.1 mol Al与足量该硫酸反应产生3 g氢气
C.配制90 mL 4.6 mol·L-1的稀硫酸需取该硫酸25 mL
D.配制500 mL 4.6 mol·L-1的稀硫酸时,定容时仰视刻度线导致浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4和CO2都能与H2O形成笼状结构的水合物晶体,CH4与H2O形成的水合物俗称“可燃冰”。
(1)“可燃冰”晶体中平均每46个H2O分子构建8个笼,其中6个笼分别容纳1个CH4分子,另外2个笼分别容纳1个H2O分子,则“可燃冰”平均组成可表示为________(填化学式)。
(2)已知:
CO2(g)+nH2O(l)=CO2·nH2O(s) △H=-57.98kJ·moI-1
CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49kJ·mol-1
反应CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)的△H=________kJ·mol-1
(3)科学家提出用CO2“置换”CH4开采海底“可燃冰”的设想,提出该设想的理论依据是________。
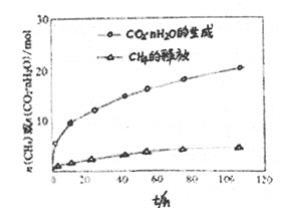
(4)图中显示,CO2·nH2O的生产速率明显大于 CH4·nH2O释放出的速率,其原因是________。
(5)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
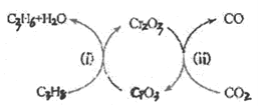
①反应(i)的化学方程式为________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出).下列说法错误的是( )
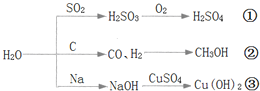
A.图中所示的反应均为氧化还原反应
B.途径![]() 是硫酸型酸雨的形成的重要途径
是硫酸型酸雨的形成的重要途径
C.工业上可用途径![]() 先制取水煤气,再合成甲醇等有机物
先制取水煤气,再合成甲醇等有机物
D.把金属钠投入到硫酸铜溶液中,发生途径![]() 反应,反应不生成铜单质
反应,反应不生成铜单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com