
【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
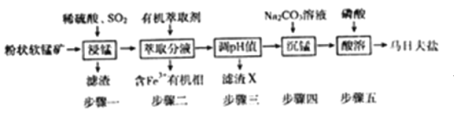
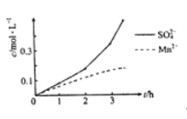
(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;
(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。
【答案】适当升温、适当增大硫酸浓度、搅拌 Mn2+为SO2(或H2SO3)与O2反应的催化剂 AD Al(OH)3 4.7≤pH<8.3或[4.7,8.3) Mn(OH)2 2.2410-6molL-1 MnCO3+2H3PO4+H2O=Mn(H2PO4)22H2O+CO2↑
【解析】
软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)加入稀硫酸溶解部分金属氧化物,通入二氧化硫进行步骤一“浸锰”操作,二氧化硫与MnO2发生氧化还原,将二氧化锰转换为Mn2+,步骤一过滤,滤渣是SiO2。步骤二加入有机萃取剂萃取Fe3+,有机相中含有Fe3+经过分液除去,步骤三对无机相进行调节pH值,使Al3+沉淀完全的同时不影响Mn2+,则调节pH范围是大于等于4.7小于8.3,然后进行过滤,滤渣X为Al(OH)3,往滤液中加入Na2CO3溶液进行“沉锰”操作,得到碳酸锰固体,加入磷酸进行酸溶可以得到马日夫盐Mn(H2PO4)2·2H2O。
(1)提高浸取率,一般可以适当增大酸的浓度、适当提高反应温度、搅拌等;步骤一中通入SO2与软锰矿中MnO2发生氧化还原,将MnO2转换为Mn2+,将SO2转化为SO42-,随着二氧化硫通入量增加,Mn2+和SO42-同等程度增大。若SO2气体中混有空气,空气中的氧气可以作氧化剂,代替MnO2,根据浓度时间变化图,开始一段时间化学反应速率较慢,Mn2+和SO42-浓度同等程度略有增大,说明氧气几乎没反应,在2h后SO42-浓度明显增大,此时Mn2+保持平缓,说明在此过程发生SO2和空气中氧气的氧化还原反应,且Mn2+作催化剂;
(2)利用物质在两种互不相溶的溶剂中溶解度的不同,式物质从一种溶剂内转移到另外一种溶剂中。物质在两种溶剂中有着不同的溶解度,称为分配定律。需要经过反复多次萃取,才可以提高萃取率和产品产率,故A项实验时分多次萃取并合并萃取液说法是正确的;萃取分液的操作如下:1.检查分液漏斗是否漏水;2.在分液漏斗中先装入溶液再加入萃取剂Y;3.振荡摇匀:塞上玻璃塞,右手拇指压住瓶塞,左手按住分液漏斗的活塞,保证不漏液,做倒转振荡,让两种液体充分混合,过程中压强增大,通过活塞放气。故B说法错误;4.将分液漏斗放置在铁架台上静置分层,C项说法错误;5.分液:将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体,分液完成,故D项说法正确;故选AD。
(3)通过分析可知,滤渣X为Al(OH)3;由离子开始沉淀和沉淀完全的pH表格可得,使Al3+沉淀完全,pH应大于等于4.7,但同时不影响Mn2+,不能使Mn2+沉淀,pH应小于8.3,故在步骤三pH应调到的范围是4.7≤pH<8.3或[4.7,8.3);
(4)步骤四时,若将Mn2+溶液滴加到Na2CO3溶液中,Na2CO3溶液显碱性,使得Mn2+沉淀生成Mn(OH)2;加入饱和Na2CO3溶液使Mn2+恰好沉淀完全生成MnCO3,溶液中存在碳酸锰的沉淀溶解平衡Ksp(MnCO3)=c(Mn2+)·c(CO32-),Mn2+恰好沉淀完全指的是c(Mn2+)=1.0×10-5,故溶液中c(CO32-)=![]() ;
;
(5)步骤五得到的MnCO3用磷酸进行酸溶,通过主要主要产物的分析,该反应没有化合价变化,不属于氧化还原,碳酸锰中的碳酸根在酸性环境下转化为二氧化碳,故产生马日夫盐晶体的化学反应方程式为:MnCO3+2H3PO4+H2O=Mn(H2PO4)22H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
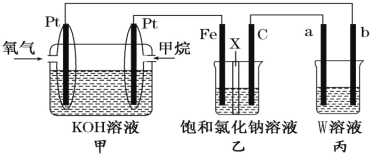
(1)石墨电极(C)作_________极,若丙池中W为Na2SO4溶液并滴有酚酞,实验开始后观察到的现象是________甲中甲烷燃料电池的负极反应式为___________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为_________ L。
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是__________________。
A.b电极为粗铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将__________________,(填“增大”“减小”或“不变”),且变化了__________________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、W、M、N原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物YW2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置________周期________族,X、Y、Z、W、M的原子半径由大到小的顺序为____________________________________(用元素符号表示)。
(2)写出YW2的电子式________;Z2X4结构式________________________________。
(3)X、Z、W形成的化合物,可用作化肥的盐是________,该物质所含化学键的类型是________。
(4)均由X、W、M、N四种元素组成的两种化合物相互反应,有刺激性气味气体放出,反应的离子方程式为____________________________________________________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的化学方程式________________________________________________________________________。
(6)写出NW2通入硝酸钡溶液中的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是
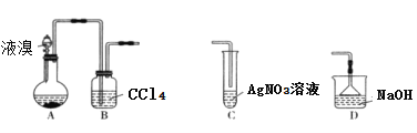
A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现,新药瑞德西韦对抗冠状病毒有效,其结构如下图,下列关于该有机物说法正确的是( )

A.不能使酸性高锰酸钾溶液褪色
B.与碱溶液反应,与酸溶液不反应
C.分子中所有碳原子一定在同一平面上
D.一定条件下,可以发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年3月11日注射用西维来司他钠获得国家药监局批准上市,用于治疗新冠病毒等造成的急性肺损伤,化合物F是合成该药物的中间体,其合成路线如下:
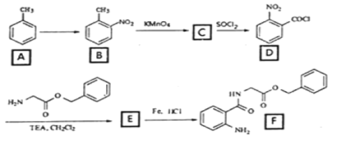
(1)E中官能团的名称是______;
(2)写出C的结构简式_______________;
(3)写出符合下列条件的B的一种同分异构体___________________;
①能发生水解反应且能发生银镜反应
②遇FeCl3溶液显蓝紫色
(4)反应A→B所需试剂及条件_________________;
(5)反应B→C的反应类型___________________;
(6)写出D→E的化学反应方程式_______________________;
(7)参考本题信息,写出由间二甲苯与NH2CH2CH制备下图有机物的合成线路_________(无机试剂任选) 。
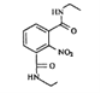
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅(Pb)与硅同主族且Pb比Si多3个电子层。
(1)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______(填“强”或“弱”)电解质。
(2)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________mol电子。
(3)在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成两种无污染的气体,该反应的化学方程式为:___________________________________。
(4)①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,溶液变蓝色,且反应后溶液呈碱性,发生反应的离子方程式是______________。
②在上述碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,写出发生反应的离子方程式是______________。
(5)处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+,再用氨水将Cr3+转变为难溶的Cr(OH)3,在该过程中氧化剂为______________,其中氨水转化Cr3+为Cr(OH)3的离子方程式为____________________________________________;该方案处理后的废水中因含有大量________元素,直接排放会导致水体富营养化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:
O3+Cl === ClO+O2 ΔH1
ClO+O === Cl+O2 ΔH2
大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图:
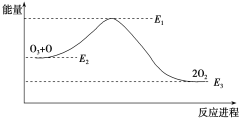
下列叙述中,正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. 2O2===O3+O 是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com