
【题目】2020年3月11日注射用西维来司他钠获得国家药监局批准上市,用于治疗新冠病毒等造成的急性肺损伤,化合物F是合成该药物的中间体,其合成路线如下:
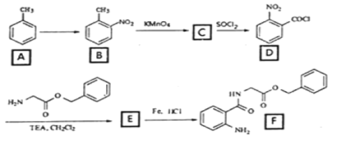
(1)E中官能团的名称是______;
(2)写出C的结构简式_______________;
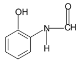
(3)写出符合下列条件的B的一种同分异构体___________________;
①能发生水解反应且能发生银镜反应
②遇FeCl3溶液显蓝紫色
(4)反应A→B所需试剂及条件_________________;
(5)反应B→C的反应类型___________________;
(6)写出D→E的化学反应方程式_______________________;
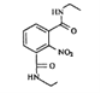
(7)参考本题信息,写出由间二甲苯与NH2CH2CH制备下图有机物的合成线路_________(无机试剂任选) 。
![]()
【答案】肽键、酯基、硝基 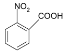
 (两个官能团在对位或间位也可以) 浓硫酸、浓硝酸、加热(浓H2SO4、浓HNO3、△) 氧化反应
(两个官能团在对位或间位也可以) 浓硫酸、浓硝酸、加热(浓H2SO4、浓HNO3、△) 氧化反应 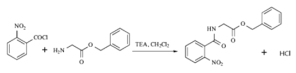
【解析】
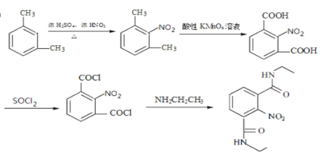
甲苯经过硝化反应生成邻硝基甲苯,邻硝基甲苯被酸性高酸酸钾氧化生成C,C是邻硝基苯甲酸 ,C与SOCl2发生取代反应,生成D邻硝基苯甲酰氯
,C与SOCl2发生取代反应,生成D邻硝基苯甲酰氯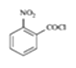 ,由E在Fe/HCl作用下生成F,发生硝基还原,则E的结构为
,由E在Fe/HCl作用下生成F,发生硝基还原,则E的结构为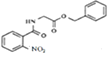 。
。
(1)由分析可知,E 中官能团的名称是肽键、酯基、硝基;
中官能团的名称是肽键、酯基、硝基;
(2)由分析可知,C的结构简式 ;
;
(3)符合B的一种同分异构体:①能发生水解反应且能发生银镜反应,分子内存在HCONH-,②遇FeCl3溶液显蓝紫色,分子内含有-OH,故符合题意的B的同分异构体 (两个官能团在对位或间位也可以);
(两个官能团在对位或间位也可以);
(4)由分析可知,A→B发生硝化反应,故所需试剂及条件浓硫酸、浓硝酸、加热(浓H2SO4、浓HNO3、△);
(5)反应B→C经酸性高锰酸钾氧化,-CH3转化为-COOH,故反应B→C的反应类型为氧化反应;
(6)由分析可知E的结构简式 ,D→E发生取代,分子间脱去一分子HCl,故化学反应方程式
,D→E发生取代,分子间脱去一分子HCl,故化学反应方程式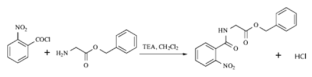 ;
;
(7)由原料和产物对比分析,间二甲苯需要先引入硝基,后经过氧化转化为-COOH,与SOCl2发生取代反应得到酰氯,然后可以与氨基发生脱HCl生成肽键,故制备流程是: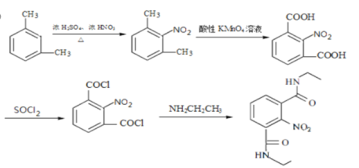 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
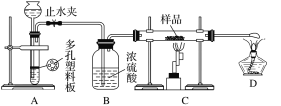
(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
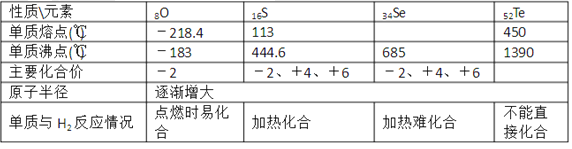
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年以来,世界多地发生了新冠病毒肺炎,威胁着人们的身体健康。抗击新冠肺炎疫情中,“84”消毒液、双氧水和“一次性口罩”起了非常重要的作用。下列正确的有( )
A.医用口罩中的过滤层所用的材料是熔喷聚丙烯,聚丙烯的结构可表示![]()
B.“84”消毒液的主要有效成分是NaClO,在NaClO固体中含有的化学键只有离子键
C.双氧水的结构式为 H-O-O-H,分子间可形成氢键
D.NaClO的电子式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
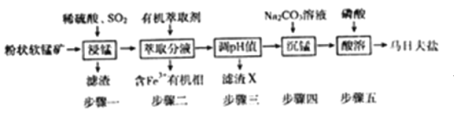
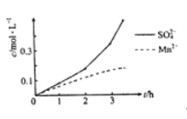
(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;
(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
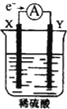
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是

A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
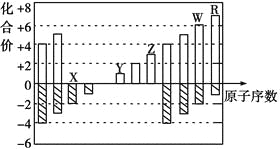
A.离子半径:Y>Z>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com