
【题目】近年来,我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法正确的是

A.阴极的电极反应式为4OH--4e-=O2↑+2H2OB.阳极的电极反应式为Zn-2e-=Zn2+
C.通电时,该装置为牺牲阳极的阴极保护法D.断电时,锌环失去保护作用
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
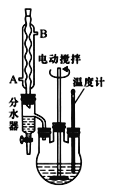
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得(已知苯甲酸的酸性强于碳酸),反应装置如图(部分装置省略),反应原理如下:
 +C2H5OH
+C2H5OH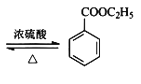 +H2O
+H2O
实验操作步骤:
①向三颈烧瓶内加入12.2 g苯甲酸、25 mL乙醇、20 mL苯及4 mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80 mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210—213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8 mL。
可能用到的有关数据如下:
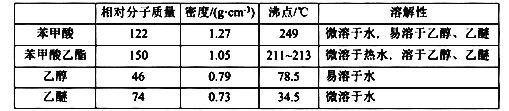
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______
(2)步骤①中加浓硫酸的作用是________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是__________。
(4)步骤③中加入碳酸钠的目的是____________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)蒸馏操作中温度计水银球的位置应为下图中________(填a、b、c、d)所示。
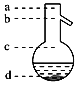
(7)本实验所得到的苯甲酸乙酯产率______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为![]() 的是
的是![]()
![]()
A.液面在“0”刻度时,![]() 碱式滴定管和
碱式滴定管和![]() 碱式滴定管所盛液体的体积
碱式滴定管所盛液体的体积
B.相同温度下,![]() 醋酸溶液和
醋酸溶液和![]() 醋酸溶液中的
醋酸溶液中的![]()
C.在![]() 溶液中,
溶液中,![]() 与
与![]()
D.相同温度下,等浓度的![]() 和NaOH溶液,前者与后者的
和NaOH溶液,前者与后者的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、![]() (y)、
(y)、![]() (z)的分子式均为C5H6。下列说法正确的是
(z)的分子式均为C5H6。下列说法正确的是
A.x、y、z均能使酸性高锰酸钾溶液褪色
B.z的同分异构体只有x和y两种
C.z的一氯代物只有一种,二氯代物只有两种(不考虑立体异构)
D.x分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁溶液和过量碳酸氢铵溶液混合,过滤、洗涤、干燥得到碳酸亚铁,在空气中灼烧碳酸亚铁得到铁的氧化物M。利用滴定法测定M的化学式,其步骤如下:
①称取3.92g样品M溶于足量盐酸,并配成100mL溶液A。
②取20.00mL溶液A于锥形瓶中,滴加KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生气泡。
③待气泡消失后,用1.0000 mol·L-1 KI标准溶液滴定锥形瓶中的Fe3+,达到滴定终点时消耗KI标准溶液10.00 mL。
(1)实验中必需的定量仪器有量筒、电子天平、____________和____________。
(2)在滴定之前必须进行的操作包括用标准KI溶液润洗滴定管、__________、___________。
(3)步骤②中“气泡”有多种可能,完成下列猜想:
①提出假设:
假设1:气泡可能是SCN-的反应产物N2、CO2、SO2或N2,CO2。
假设2:气泡可能是H2O2的反应产物____________,理由___________。
②设计实验验证假设1:
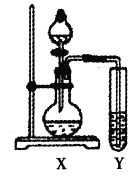
试管Y中的试剂是_______。
(4)根据上述实验,写出硫酸亚铁溶液和过量碳酸氢铵溶液混合制备碳酸亚铁的离子方程式_____。
(5)根据数据计算,M的化学式为_______。
(6)根据上述实验结果,写出碳酸亚铁在空气中灼烧的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.放热反应一定能自发的进行
B.SO2能使品红溶液和溴水褪色,说明SO2具有漂白性
C.将AlCl3溶液和Al2(SO4) 3溶液分别蒸干灼烧,所得产物均为Al2O3
D.由反应AgCl(s) +KI(aq)![]() Ag I(s) + KCl (aq) 可知Ksp(AgCl)>Ksp(Ag I)
Ag I(s) + KCl (aq) 可知Ksp(AgCl)>Ksp(Ag I)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuSO4溶液。
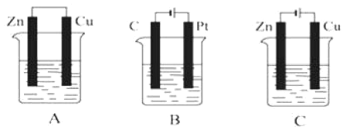
(1)A、B、C三个装置中属于原电池的是___(填字母,下同),属于电解池的是___。
(2)A池中Cu电极上发生的是___(填“氧化”或“还原”)反应。
(3)B池中C是___极,Pt极发生的反应的电极反应式为___。
(4)C池反应过程中,CuSO4溶液的物质的量浓度___(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。

③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com