
【题目】对于如图所示原电池装置描述,下列说法正确的是( )
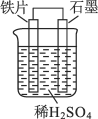
A. 石墨电极作正极
B. 铁片上的反应:Fe -3e- =Fe3+
C. 铁电极附近溶液中氢离子浓度增大
D. 电子由石墨电极通过导线流向铁电极
【答案】A
【解析】
在用铁、石墨和硫酸组成的原电池装置中,铁的活泼性大于石墨的活泼性,所以铁片作负极,负极上铁失去电子发生氧化反应,石墨作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,以此解答。
A. 在用铁、石墨和硫酸组成的原电池装置中,铁的活泼性大于石墨的活泼性,所以铁片作负极,石墨作正极,A项正确;
B. 铁片作负极,铁失去电子发生氧化反应,电极反应式为:Fe - 2e- = Fe2+, B项错误;
C. 石墨作正极,氢离子移向正极,在石墨上得电子发生还原反应,则铁电极附近溶液中氢离子移向正极,浓度减小,C项错误;
D. 电子从负极沿导线流向正极,即从铁电极流向石墨电极,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是
A. 磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
B. FeBr2中通入氯气使一半的Br氧化:2Fe2++2Br+ 2Cl2=2Fe3++Br2+4Cl
C. NH4Al(SO4)2溶液中加入过量的Ba(OH)2:NH4++Al3++2SO42-+2Ba2++4OH=NH3·H2O+AlO2-+2BaSO4↓+H2O
D. 饱和FeCl3溶液滴入沸水制氢氧化铁胶体:Fe3++3H2O(沸水)![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
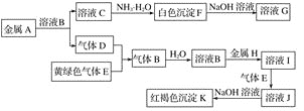
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D.  和
和 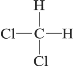
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香族化合物A制备H的一种合成路线如图:
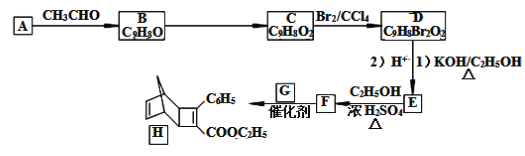
已知:
①RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题:
(1)有机物A的名称是__。E所含官能团的名称是__。
(2)已知②中物质“||”的同系物丙烯是一种医疗卫生用布——聚丙烯无纺布的原材料,用化学符号表示丙烯的结构简式为___。
(3)H能发生的反应类型分别是___。
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)D→E的反应,若只把条件(1)改为KOH/H2O,则生成物E的结构简式是__。
(5)写出E→F的化学方程式__。
(6)G为甲苯的同分异构体,G的结构简式是__。
(7)参照如图合成路线,写出用A和CH3CHO为原料经以上合成路线制备化合物C(C9H8O2)的合成路线___(其它试剂任选)。
(8)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,苯环上的烃基为乙基,其核磁共振氢谱显示苯环上有4种不同化学环境的氢,峰面积比为1:1:1:1。写出一种符合要求的X的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com