
| A. | 澄清石灰水与盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
分析 A.澄清石灰水中氢氧化钙以离子存在,书写离子方程式时要写离子;
B.电荷不守恒、转移电子不守恒;
C.过量二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠;
D.沉淀、气体、弱电解质要写化学式,醋酸和水是弱电解质.
解答 解:A.澄清石灰水中氢氧化钙以离子存在,书写离子方程式时要写离子,离子方程式为H++OH-=H2O,故A错误;
B.电荷不守恒、转移电子不守恒,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.过量二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠,离子方程式为SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故C错误;
D.沉淀、气体、弱电解质要写化学式,醋酸和水是弱电解质,离子方程式为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,明确离子方程式书写规则、反应物性质是解本题关键,书写离子方程式要遵循客观事实、原子守恒、电荷守恒和转移电子守恒,有些化学反应还与反应物的量有关,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 无水硫酸铜、蔗糖 | B. | 食盐、硫酸亚铁 | C. | 生石灰、硫酸亚铁 | D. | 硅胶、食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 分类依据 | 类别 | 性质 | |
| A | FeCl2 | 铁元素化合价 | 还原剂 | 可与O2、Zn等发生反应 |
| B | FeCl2 | 电离产生的微粒 | 盐 | 可发生水解反应,溶液显碱性 |
| C | HNO3 | 在水中能电离出H+ | 酸 | 可与CuO反应生成NO |
| D | HNO3 | 氮元素的化合价 | 氧化剂 | 可与Al、I-等发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每摩尔H2O2分子含2NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 16g甲烷分子中含4NA个氢原子 | |
| D. | 100mL 1mol/L Na2SO4溶液含有0.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A的一种单质是太阳能电池中的主要材料 | |
| B. | 元素C的某单质与过氧化钠的漂白原理类似 | |
| C. | B和E可组成一种耐高温的结构材料,其化学式为E4B3 | |
| D. | 工业上制取E单质时,生成的气体主要是AO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
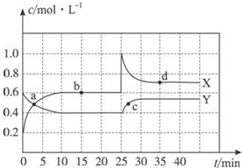 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 加热前D的试管中闻 到特殊香味,加热后只有C仍有分层现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com