
【题目】水是生命之源,是工业的血液,是农业的命脉。在下列的反应中,水的作用是什么?
A.氧化剂 B.还原剂 C.既是氧化剂,又是还原剂
D.既不是氧化剂又不是还原剂 E.氧化产物 F.还原产物
G.既是氧化产物,又是还原产物 H.既不是氧化产物,又不是还原产物
① Cl2+H2O = HCl+HClO 水的作用是 ___________ ;
② 2H2O2 = 2H2O +O2↑ 水的作用是 ___________ ;
③ 2H2O ![]() 2H2↑+O2↑ 水的作用是 ___________ ;
2H2↑+O2↑ 水的作用是 ___________ ;
④ H2 +CuO = Cu +H2O 水的作用是 ___________ ;
⑤2HCl+2NaH+O2 =2NaCl+2H2O 水的作用是 ___________ ;
⑥2F2+2H2O = 4HF+O2↑ 水的作用是 ___________ ;
⑦2Na+2H2O = 2NaOH+H2↑ 水的作用是 ___________ ;
⑧Cl2+2NaOH = NaCl+NaClO+H2O 水的作用是 ___________ 。
【答案】D F C E G B A H
【解析】
A.氧化剂 B.还原剂 C.既是氧化剂,又是还原剂
D.既不是氧化剂又不是还原剂 E.氧化产物 F.还原产物
G.既是氧化产物,又是还原产物 H.既不是氧化产物,又不是还原产物
①在 Cl2+H2O = HCl+HClO 反应中Cl2 发生歧化反应,水是反应物,既不是氧化剂又不是还原剂 。答案:D ;
② 在2H2O2 = 2H2O +O2↑反应中,水是还原产物,答案:F;
③ 在2H2O ![]() 2H2↑+O2↑反应中,水既是氧化剂,又是还原剂,答案:C;
2H2↑+O2↑反应中,水既是氧化剂,又是还原剂,答案:C;
④ 在H2 +CuO = Cu +H2O 反应中,水是生成物,水的是氧化产物,答案:E;
⑤在2HCl+2NaH+O2 =2NaCl+2H2O 反应中,水是生成物,水既是氧化产物,又是还原产物,答案:G;;
⑥在2F2+2H2O = 4HF+O2↑反应中,水是还原剂;答案:B。
⑦在2Na+2H2O = 2NaOH+H2↑反应中,水是氧化剂,答案:A;
⑧在Cl2+2NaOH = NaCl+NaClO+H2O反应中水是生成物,水既不是氧化产物,又不是还原产物,答案:H。


科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系,下列说法正确的是
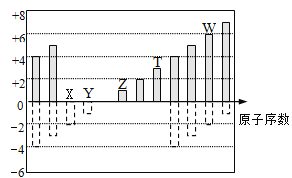
A. 最高价氧化物对应水化物酸性: Y>W>T
B. 气态氢化物的稳定性: W>X
C. 单质还原性:T>Z
D. Z、T、W的最高价氧化物对应水化物可以相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是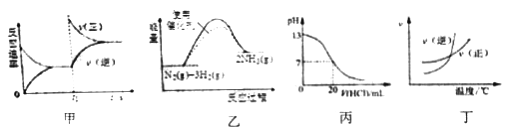
A. 图甲表示t1时刻增加反应物浓度后v(正)和v(逆)随时间的变化
B. 图乙表示反应N2(g)+3H2(g)![]() 2NH3(g)△H<0在两种条件下物质能量随反应过程的变化
2NH3(g)△H<0在两种条件下物质能量随反应过程的变化
C. 图丙表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水时,溶液pH随加入盐酸体积的变化
D. 图丁表示的反应正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
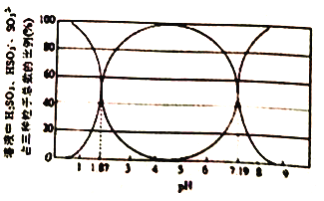
【题目】脱除工业尾气中的二氧化硫气体对物质的充分利用和环境保护有重要意义。
(1)某温度下,二氧化硫溶于水后所得溶液中H2SO3、HSO3-和SO32-占三种粒子总数的比例随pH 的变化如图所示。则在pH 为3时,溶液中H2SO3、HSO3-和SO32-的浓度最大的为_____。该温度下H2SO3 的电离平衡常数Ka1=_________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收空气中含有的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O![]() H2NCOONH4 (氨基甲酸铵)。
H2NCOONH4 (氨基甲酸铵)。
①当该反应处于平衡状态时,下列措施中有利于提高尿素水解程度的是____(填字母)。
a.升高反应温度 b.延长反应时间
c.增大尿素的浓度 d.向装置中充入SO2和空气混合物
②氨基甲酸铵会与空气中的SO2和O2反应:2 H2NCOONH4 (aq)+2SO2(g)+2O2(g)+H2O![]() 2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
2(NH4)2SO4(aq )+2CO2(g),判断该反应达到平衡状态的标志是_______(填字母)。
a.SO2和CO2浓度相等 b. SO2百分含量保持不变
c.容器中气体的压强不变 d.CO2的生成速率与SO2的消耗速率相等
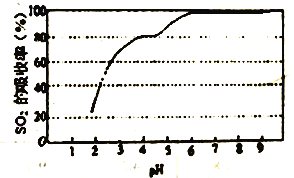
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图所示。尿素溶液吸收空气中的SO2后溶液的pH 会降低,为提高SO2 的吸收率和充分回收产物,应控制溶液pH 为_____。
(3)工业上也常用氨水吸收SO2 。25℃时将SO2通入氨水中,当产物恰好为NH4HSO3时,溶液为_____ (填酸性、中性或碱性)。当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=__________。己知25℃,NH3·H2O 的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示1 g O2与1 g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是
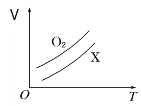
A. C2H4 B. CH4
C. CO2 D. NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子化合物的叙述正确的是( )
A.离子化合物中都含有离子键
B.离子化合物中的阳离子只能是金属离子
C.离子化合物一定可以导电
D.溶于水可以导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
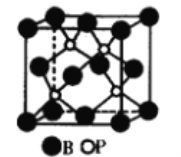
【题目】硼、磷元素在化学中有很重要的地位,硼、磷及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。回答下列问题。
(1)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图是磷化硼晶体的晶胞示意图,则磷化硼的化学式为_____,该晶体的晶体类型是_______。
(2)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如下图]。
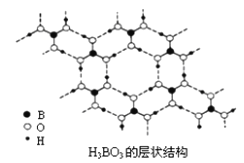
①硼酸分子中B最外层有_______个电子,1molH3BO3的晶体中有_______mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为____________元酸,[B(OH)4]-含有的化学键类型为________。
(3)四(三苯基膦)钯分子结构如图:
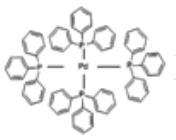
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为_____;判断该物质在水中溶解度并加以解释________。该物质可用于如图所示物质A的含成。物质A中碳原子杂化轨道类型有_______个;一个A分子中手性碳原子数目为_____。
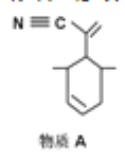
(4)在图示中表示出四(三苯基膦)钯分子中配位键____________
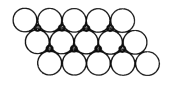
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距高最近的两个阳离子核间的距离为_______(用合有a的代数式表示)。在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_______g(氧离子的半径为1.40×10-10m,令![]() ≈l.7)。
≈l.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,正确的是( )
A. 基态核外电子的排布为![]() 的原子3p能级有一个空轨道
的原子3p能级有一个空轨道
B. 第四周期中,未成对电子数最多的原子为Mn
C. Fe2+的基态核外电子排布为1s22s22p63s23p63d6
D. 2p能级有2个未成对电子的基态原子的价电子排布一定为2s22p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com