
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
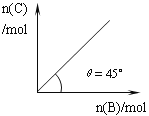
A. 若保持压强一定,当温度升高后,则图中θ>45°
B. 若再加入B,则再次达到平衡时正、逆反应速率均逐渐增大
C. 若保持压强一定,再加入B,则反应体系气体密度减小
D. 平衡时B的转化率为50%
【答案】D
【解析】试题分析:A、温度升高,平衡逆向移动,一定物质的量的B反应生成的C的物质的量减少,所以角度变小,错误,不选A;B、加入B,平衡正向移动,正反应速率突然增大,逆反应速率不变,平衡开始移动,正反应速率减慢,逆反应速率增大,错误,不选B;C、根据图像分析,加入的B的物质的量与生成C的物质的量相等,所以该反应中有一半的B物质反应,假设加入的B的物质的量为nmol,则
A(s)+2B(g) 4C(g)+D(g)
起始 n/2 n 0 0
改变 n/4 n/2 n n/4
平衡 n/4 n/2 n n/4
混合气体的密度=(nMA/2+NMB)/(n/2+n+n/4)V=( nMA/2+NMB)/(7nV/4),根据气体密度公式分析,气体的密度与加入B的多少无关,所以若再加入B ,则再次达到平衡,反应体系中气体密度始终不变,错误,不选C;D、根据图像结合方程式可知,加入B的物质的量与生成C的物质的量相等,所以该反应中有一半的B反应,所以其转化率为50%,正确,选D。


科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.硫酸铁易溶于水,可用作净水剂
B.次氯酸具有弱酸性,可用作漂白剂
C.氧化钙能与水反应,可用作食品干燥剂
D.晶体硅熔点高,可用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l) △H=-285.8kJ·mol-1
2H2O(l) △H=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g) △H=2×283.0 kJ/mol
2CO(g)+O2(g) △H=2×283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);△H =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物油和水、酒精和水、碘的饱和水溶液,这三组混合物的分离方法分别是( )
A. 过滤、蒸馏、分液 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、过滤 D. 萃取、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H=24.8 kJ·mol1
2Fe(s)+3CO2(g) △H=24.8 kJ·mol1
Fe2O3(s)+![]() CO(g)
CO(g)![]()
![]() Fe3O4(s)+CO2(g) △H=15.73 kJ·mol1
Fe3O4(s)+CO2(g) △H=15.73 kJ·mol1
Fe3O4(s)+CO(g) ![]() 3FeO(s)+CO2(g) △H=+640.4 kJ·mol1
3FeO(s)+CO2(g) △H=+640.4 kJ·mol1
则14g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为
A.218 kJ·mol1 B.109 kJ·mol1 C.+218 kJ·mol1 D.+109 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A.明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用
B.淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象
C.合金、光导纤维、碳纤维、玻璃钢都属于复合材料
D.光化学烟雾、臭氧层空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com