
【题目】植物油和水、酒精和水、碘的饱和水溶液,这三组混合物的分离方法分别是( )
A. 过滤、蒸馏、分液 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、过滤 D. 萃取、过滤、蒸馏
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,下列说法正确的是( )。
A. 铜和铁都是热和电的良导体
B. 棉纱和蚕丝都属于合成纤维
C. 玻璃和光导纤维都是硅酸盐材料
D. 聚氯乙烯不可制成食品保鲜膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol/L的NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol/L的NaOH溶液中充分反应,放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是
A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.2CO2(g)+2NaOH(l)===2NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
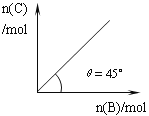
A. 若保持压强一定,当温度升高后,则图中θ>45°
B. 若再加入B,则再次达到平衡时正、逆反应速率均逐渐增大
C. 若保持压强一定,再加入B,则反应体系气体密度减小
D. 平衡时B的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验: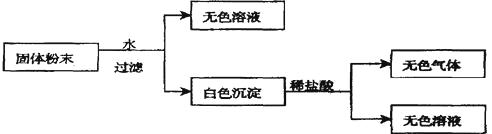
从实验可以判断,该固体粉末中一定不含有 , 它的组成可能是或。发生反应的离子方程式为 。要进一步确定其组成还应进行的实验操作是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷与硝酸银溶液混合,未见沉淀物发生,以下解释中理由最充分的是
A.溴乙烷是共价化合物B.硝酸银是强电解质
C.溴乙烷属非电解质D.溶液未酸化、未加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com