
? ? |
| A | ? ? |
? ? |
| A | ? ? |
? ? |
| A | ? ? |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
A、8个中子的碳原子的核素符号:
| ||
B、H2O的电子式: | ||
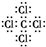
C、Cl-的结构示意图: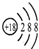 | ||
D、CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核内没有中子 |
| B、M层有5个电子 |
| C、原子核外最外层电子数=电子层数 |
| D、N层上电子数与K层电子数相等,次外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①、②、③、⑤、⑥ |
| B、②、③、⑤、⑥ |
| C、②、③、⑤、⑥、⑦ |
| D、②、③、④、⑥、⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
常用于制备药物和合成高分子材料.(1)化合物Ⅰ的分子式为
 +CH3COOH→
+CH3COOH→ .聚合物可用于制备
.聚合物可用于制备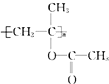
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
 下表中各组物质之间不能通过一步反应实现如图的是( )
下表中各组物质之间不能通过一步反应实现如图的是( ) | 甲 | 乙 | 丙 | |
| A | NaHCO3 | Na2CO3 | NaCl |
| B | SiO2 | HSiO3 | Na2SiO3 |
| C | Cl2 | HCl | CuCl2 |
| D | AlCl3 | Al(OH)3 | Al2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 液反应生成盐;丙、戊可组成化合物M.
液反应生成盐;丙、戊可组成化合物M.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com