
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
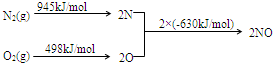

| ||
| ||


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| A、Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 |
| B、氨气是一种碱性气体,可用P2O5或无水CaCl2干燥 |
| C、SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力 |
| D、油脂在碱性条件下易水解,可用于制作肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该酸式盐的水溶液一定显酸性 |
| B、在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
| C、若HY-能水解,水解方程式为:HY-+H2O?Y2-+H3O+ |
| D、若HY-能电离,电离方程式为:HY-+H2O?Y2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N03-、HC03-、H+ |
| B、Na+、N03-、Cl- |
| C、H+、K+、OH- |
| D、S042-、Na+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
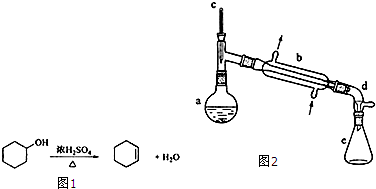
| 相对分 子质量 |
密度 (g?cm-3) |
沸点 ℃ |
溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 B.
B. C.
C.
 E.
E. F.2-甲基丁烷和2,2-二甲基丙烷
F.2-甲基丁烷和2,2-二甲基丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:

 转变为
转变为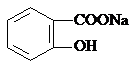 的流程为
的流程为
查看答案和解析>>
科目:高中化学 来源: 题型:
A、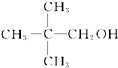 |
| B、CH3CH2CH2CH2Cl |
| C、HO-CH2-CH2-COOH |
| D、Cl-CH2-COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com