
(三选一---化学与技术)
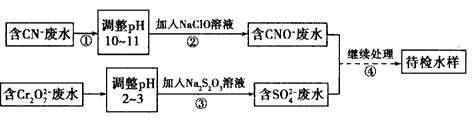
某电镀铜厂有两种废水需要处理,一种废水中含有CN-,另一种废水中含有 Cr2O72- 。该厂拟定如图所示的废水处理流程。
科目:高中化学 来源:山东省模拟题 题型:填空题
 4CH2=CHCl+2H2O),再用氯乙烯聚合生产这种塑料,该过程的反应方程式为:______________。
4CH2=CHCl+2H2O),再用氯乙烯聚合生产这种塑料,该过程的反应方程式为:______________。查看答案和解析>>
科目:高中化学 来源:湖北省模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:山西省月考题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:山东省月考题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
(三选一----化学与技术)
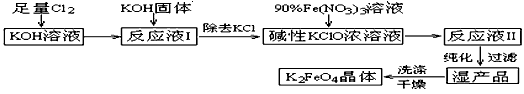
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com