
【题目】向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )
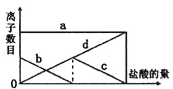
A. a:K+; b:HCO3—;c:CO32—;d:Cl—
B. a:K+; b:CO32—;c:HCO3—;d:Cl—
C. a:K+; b:CO32—;c:Cl—;d:HCO3—
D. a:K+; b:HCO3—;c:Cl—;d:CO32—
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br﹣、2Fe3++2I﹣═2Fe2++I2 , 则下列有关说法中不正确的是( ) 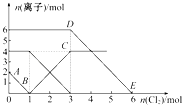
A.还原性:I﹣>Fe2+>Br﹣
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n(Br﹣)=6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是
A. 某溫度时的混合溶液中C(H+) =![]() mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 活化分子间的碰撞一定能发生化学反应
B. 升高温度时,化学反应速率加快,主要原因是反应物分子的能量增加,活化分子百分数增大,单位时间内有效碰撞次数增多
C. 自发进行的反应一定迅速
D. 凡是熵增加的过程都是自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0.5mol能与1molHCl加成,转变为氯代烷烃,加成后产物分子上的氢原子又可被3mol氯分子完全取代,则该烃可能是 ( )
A. CH≡CHB. CH≡C—CH3
C. CH3—C≡C—CH3D. CH2=CH—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的氧化剂是 ,
(2)该反应中,发生还原反应的过程是→ ,
(3)写出该反应的化学方程式,并用双线桥标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产工艺流程如下:

(1)操作1的操作是_________;
(2)升高pH至4.0~4.5的目的是_______________ ;
(3)生产过程中可回收使用的物质是__________(写物质名称);
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用______(填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)通过该法得到一种化学式为[Al2(OH)2Cl45H2O]10的(M=320 g/mol)聚合氯化铝晶体,为测定产品纯度,进行如下操作:
①称取1.600g样品,用适量盐酸溶解后配成100.00 mL溶液;
②取25.00 mL溶液,控制pH=3.5,加入过量0.1 mol/L 40 mL EDTA(Na2H2Y2H2O)标准液滴定(Al3+ + H2Y2 = AlY + 2H+),加热煮沸5~10分钟,使Al3+与EDTA结合稳定(EDTA与Al3+结合无色);
③待上一步结束后,调节溶液pH至5~6,加入二甲酚橙作指示剂,用0.1 mol/L标准Zn2+溶液滴定多余的EDTA(Zn2+ + H2Y2 = ZnY2 + 2H+),消耗标准液20.00 mL(已知:二甲酚橙与Zn2+形成的配合物是红紫色的溶液)滴定终点的现象是_________________;产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把表面有氧化物的铜片和铁片一起放入盐酸中充分反应后铁片未完全溶解,在该溶液中的金属离子应是( )
A. 只有Fe2+ B. Fe3+和Cu2+
C. Fe2+和Cu2+ D. Fe3+和Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com