
已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类肯定不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,它们的阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)====c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-))
C
【解析】
试题分析:由题意可知H2A是弱酸,因此NaHA溶液中既存在电离平衡(HA-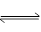 H++A2-)又存在水解平衡(HA-+H2O
H++A2-)又存在水解平衡(HA-+H2O H2A+OH-),由电荷守恒可知,C正确;在Na2S水溶液中存在Na2S的两级水解平衡(S2-+H2O
H2A+OH-),由电荷守恒可知,C正确;在Na2S水溶液中存在Na2S的两级水解平衡(S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-),溶液显碱性,c(OH-)>c(H+),D错;两种溶液中存在相同的离子,A错;由于水解程度不同,物质的量浓度相同的溶液中,阴离子总数不相等,B错,所以正确的答案选C。
H2S+OH-),溶液显碱性,c(OH-)>c(H+),D错;两种溶液中存在相同的离子,A错;由于水解程度不同,物质的量浓度相同的溶液中,阴离子总数不相等,B错,所以正确的答案选C。
考点:考查弱电解质的电离平衡,盐溶液中的水解平衡及溶液中离子浓度之间的关系
点评:该题是中等难度的试题,试题综合性强,注重解题的灵活性,侧重能力的培养。有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题,特别是灵活运用基础知识解决实际问题的能力。该题难度较大,学生不易得分。


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
A.3倍 B.1/3倍 C.103倍 D.10-3倍
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波万里国际学校高二下学期期末考试化学试卷(带解析) 题型:填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显____(填“酸性”、“中性”或“碱性”),理由是:______(用离子方程式或必要的文字说明)。
(2)常温下,已知0.1 mol·L-1 NaHA溶液pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能_______0.11 mol·L-1(填“大于”、“等于”或“小于”),理由是______。
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_______ ___。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区七校高二上学期期中考试化学试卷(解析版) 题型:填空题
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 B.c(SO42-)+c(HSO4-)=2 c(Na+)
C.c(OH-)=c(H+)+c(HSO4-) D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “=” 或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显____(填“酸性”、“中性”或“碱性”),理由是:______(用离子方程式或必要的文字说明)。
(2)常温下,已知0.1 mol·L-1 NaHA溶液pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能_______0.11 mol·L-1(填“大于”、“等于”或“小于”),理由是______。
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_______ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com