
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
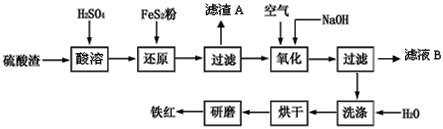
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
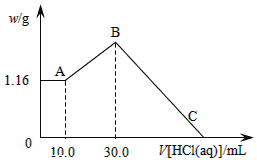
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
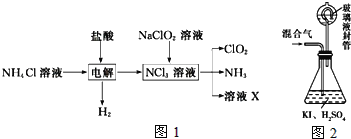
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【答案】Fe2O3+6H+=2Fe3++3H2O FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+ 3.2~3.8 5.20 130.0 0.02700 d
【解析】
硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红。
(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3+ +3H2O。
(2)FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,检验Fe3+被完全还原的实验操作和现象为取少量试液于试管中,滴入几滴KSCN溶液,若不显红色,则说明Fe3 +已被完全还原,故答案为:FeS2+14Fe3 + +8H2O=15Fe2++2SO42-+16H+。
(3)溶液pH>3.2时Fe3+沉淀完全,溶液pH=3.8时Al3+开始沉淀,故溶液的pH的范围是3.2~3.8,根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;故答案为:3.2~3.8。
(二)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100mL,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30mL+100mL=130.0mL,故答案为:130.0mL。
(三)①含有Na2S2O3物质的量为0.02L×0.1mol/L=0.002mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,所以m(ClO2)=0.0004 mol×67.5g/mol=0.02700g,故答案为:0.02700。
②若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,故答案为:d。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )

A.NaCl溶液是电解质
B.在通电的条件下,NaCl在水中电离出大量的离子而导电
C.NaCl固体中无阴阳离子,因此不能导电
D.同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
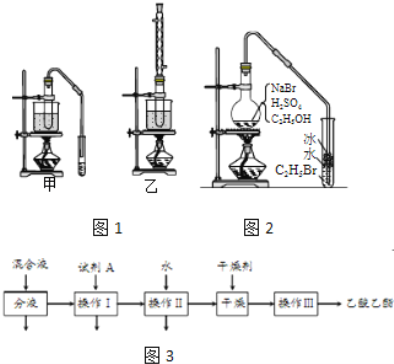
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断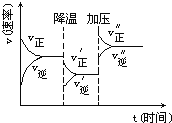
A. A、B、C、D均为气体
B. 若A、B是气体,则C、D是液体或固体
C. 温度越高,K越大
D. 在整个过程中,A的转化率一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Pt-g-C3N4为催化剂,用光催化氧化法脱除NO的过程如图所示。
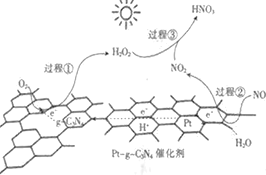
该脱除过程中,下列说法不正确的是
A. 该过程为太阳能转化为化学能
B. Pt端发生的是氧化反应
C. 过程①发生的电极反应为H2O2-2e-=O2↑+2H+
D. 过生③的化学方程式为2NO2+H2O2=2HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是
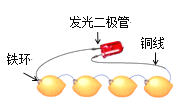
A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用I2O5可使CO与H2O(g)反应转化为CO2和H2,从而有效减少大气污染。该过程可通过图1所示的两步反应循环实现。
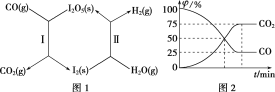
其中:反应Ⅰ为I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1
反应Ⅱ中,生成1 mol H2(g)时,反应热ΔH=b kJ·mol-1。
①总反应的热化学方程式为(反应热ΔH用含a、b的代数式表示)______。
②在恒温密闭容器中加入一定量的CO(g)和I2O5(s),发生反应Ⅰ并达到平衡。测得体系中各气体组分的体积分数φ随时间t的变化如图2所示。则此反应用气体分压表示的平衡常数Kp=______(已知:气体分压=气体总压×体积分数)。
(2)已知铅盐中,Pb(NO3)2、(CH3COO)2Pb易溶于水,PbSO4、PbS难溶于水,室温下其溶度积常数为Ksp(PbSO4)=1.06×10-8;Ksp(PbS)=3.40×10-28。
①将一定量的PbSO4加入足量饱和CH3COONH4溶液中,微热,并不断搅拌,因发生复分解反应,PbSO4缓慢溶解。能发生此复分解反应的原因是______。
②某溶液中主要含有S2-、SO42-等阴离子,向其中滴加Pb(NO3)2溶液,当PbSO4开始析出时,溶液中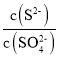 =________。
=________。
(3)钛基二氧化铅(Ti/PbO2)是重要的电极材料,工业上用电解法制作,主要流程如图:
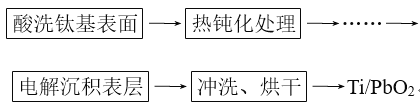
其中“电解沉积表层”是制作的关键,方法是电解可溶性铅盐溶液,使生成的PbO2沉积在阳极金属钛(Ti)上。主反应为2Pb2++2H2O=Pb+PbO2+4H+。
①必须预先将阳极金属钛进行“热钝化处理”,原因是_______。
②电解槽中,阳极主要的反应式为___;该法的缺点是阳极、阴极均会发生副反应。其中阴极上产生的气体副产物是____。
③电解法制得的PbO2晶体中含有少量的+2价铅,从而导致氧原子所在位置出现少量“空穴”(即化学式为PbOx,但x<2)。若电解时每生成1molPbOx转移1.94NA个e-(NA为阿伏加德罗常数的值),则铅元素中+2价铅所占的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com