
| A、Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag |
| B、CaCO3和盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、Fe和稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| D、Ba(OH)2与稀H2SO4反应:OH-+H++Ba2++SO42-=BaSO4↓+H2O |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热反应在常温条件下一定很容易发生 |
| C、反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 |
| D、灼热的炭与二氧化碳的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+0.2mol/L |
| B、Zn2+0.2mol/L |
| C、CO32- 0.2mol/L |
| D、Ca2+0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种分散系的分散质均能通过滤纸 |
| B、胶体在一定的条件下也能稳定存在 |
| C、溶液和胶体通常都是无色透明的液体,而浊液不透明 |
| D、胶体区别于其他分散系的本质特征是产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时,5.4mL水中所含的水分子数是0.3NA(4℃时,水的密度为1.0g/ml) |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | SO42- | NO3- |
| 浓度/mol?L-1 | 2×10-6 | 3×10-6 | 2×10-5 | 1.5×10-5 |
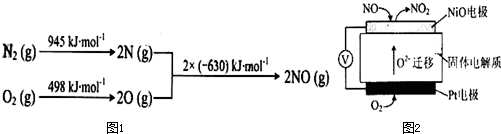
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com