
| A、三种分散系的分散质均能通过滤纸 |
| B、胶体在一定的条件下也能稳定存在 |
| C、溶液和胶体通常都是无色透明的液体,而浊液不透明 |
| D、胶体区别于其他分散系的本质特征是产生丁达尔现象 |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
| A、CO32-+2H2O?H2CO3+2OH- |
| B、NH4++H2O?NH3?H2O+H+ |
| C、Al3++3H2O?Al(OH)3↓+H2O |
| D、HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32克氧气占有的体积约为22.4L |
| B、22.4L氮气含有阿佛加德罗常数个氮气分子 |
| C、在标况下22.4L水的质量约为18克 |
| D、22克二氧化碳与标况下11.2 LHCl约含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag |
| B、CaCO3和盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、Fe和稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| D、Ba(OH)2与稀H2SO4反应:OH-+H++Ba2++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤ | B、①③④⑤ |
| C、②③④⑤⑥ | D、①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、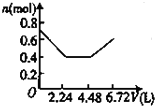 |
B、 |
C、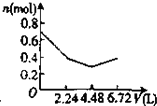 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com