
| A、CO32-+2H2O?H2CO3+2OH- |
| B、NH4++H2O?NH3?H2O+H+ |
| C、Al3++3H2O?Al(OH)3↓+H2O |
| D、HCO3-+H2O?H3O++CO32- |


科目:高中化学 来源: 题型:
| A、向纯水中投入一小块金属钠 |
| B、将水加热煮沸 |
| C、向水中加入Na2CO3 |
| D、向水中加入NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①<②<③ |
| B、②<①<③ |
| C、①<③<② |
| D、③<①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
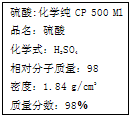
| A、该硫酸的物质的量浓度为9.2 mol/L |
| B、12gC与足量该硫酸共热反应,生成标准状况下气体体积为44.8L |
| C、1 mol Fe与足量的该硫酸反应产生2 g氢气 |
| D、配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+0.2mol/L |
| B、Zn2+0.2mol/L |
| C、CO32- 0.2mol/L |
| D、Ca2+0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
| B、大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
| C、向稀硫酸溶液中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
| D、稀硫酸跟氢氧化钡溶液混合:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种分散系的分散质均能通过滤纸 |
| B、胶体在一定的条件下也能稳定存在 |
| C、溶液和胶体通常都是无色透明的液体,而浊液不透明 |
| D、胶体区别于其他分散系的本质特征是产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
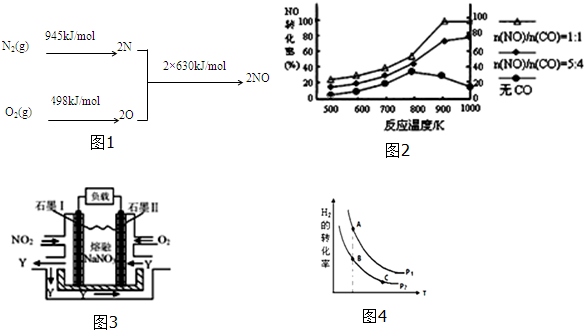
| n(NO) |
| n(CO) |
| n(NO) |
| n(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com