
【题目】那格列奈M( )是一种重要的降血糖药物,能有效促进胰岛素的分泌。它的一种合成方法如下
)是一种重要的降血糖药物,能有效促进胰岛素的分泌。它的一种合成方法如下

已知:E+H2O![]() F+CO2↑+NH3↑
F+CO2↑+NH3↑
请回答下列问题,
(1)B的化学名称为 _______;M的分子式为 ________ 。
(2)反应②的类型为________________;, F 中含有的宫能团名称为______________。
(3)写出E →F的化学方程式:________________。
(4)吡啶是一种有机碱.请从平衡的角度分析其在反应④中的作用是__________。
(5)写出满足下列条件的F的所有同分异构体的结构简式:____________ 。
①分子中含有苯环和—NH2;
②能发生银镜反应:
③1H—NMR谱显示分子中共有四种不同化学环境的氢。
【答案】苯甲醛 C19H27NO3 消去反应 羧基、氨基 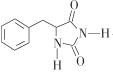 +2H2O→
+2H2O→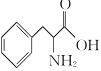 +CO2↑+NH3↑ 吸收生成的 HCl,促使反应平衡正向移动,有利于提高那格列奈产率
+CO2↑+NH3↑ 吸收生成的 HCl,促使反应平衡正向移动,有利于提高那格列奈产率 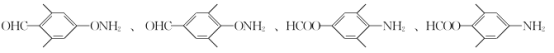
【解析】
利用逆推法由M和H及E、F的分子式,推出F为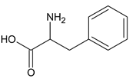 ,再结合C、D分子式逆推出B为苯甲醛,得到流程中的各步变化为:A
,再结合C、D分子式逆推出B为苯甲醛,得到流程中的各步变化为:A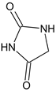 与B
与B![]() 发生加成反应生成C,C为
发生加成反应生成C,C为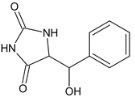 ,C在酸性条件下发生消去反应生成D,D为
,C在酸性条件下发生消去反应生成D,D为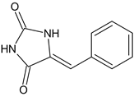 ,D在催化剂作用下与氢气加成生成E,E为
,D在催化剂作用下与氢气加成生成E,E为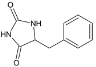 ,E发生
,E发生 +2H2O→
+2H2O→ +CO2↑+NH3↑,得到F,F为
+CO2↑+NH3↑,得到F,F为 ,F与H
,F与H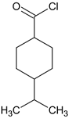 发生取代反应生成M,M为
发生取代反应生成M,M为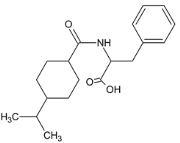 ,M的分子式为:C19H27NO3。
,M的分子式为:C19H27NO3。
(1)B的结构简式为:![]() ,化学名称为苯甲醛;M的结构简式为:
,化学名称为苯甲醛;M的结构简式为: ,分子式为C19H27NO3。故答案为:苯甲醛;C19H27NO3;
,分子式为C19H27NO3。故答案为:苯甲醛;C19H27NO3;
(2)C为 在酸性条件下发生消去反应生成
在酸性条件下发生消去反应生成 和水,反应②的类型为消去反应;为
和水,反应②的类型为消去反应;为 , F 中含有的宫能团名称为羧基、氨基。故答案为:消去反应;羧基、氨基;
, F 中含有的宫能团名称为羧基、氨基。故答案为:消去反应;羧基、氨基;
(3) 中酰胺键发生水解生成
中酰胺键发生水解生成 、水和二氧化碳,E →F的化学方程式:
、水和二氧化碳,E →F的化学方程式: +2H2O→
+2H2O→ +CO2↑+NH3↑。故答案为:
+CO2↑+NH3↑。故答案为: +2H2O→
+2H2O→ +CO2↑+NH3↑;
+CO2↑+NH3↑;
(4)F为 与H
与H 发生取代反应生成M
发生取代反应生成M 和HCl,反应④是可逆反应,吡啶是一种有机碱,从平衡的角度分析其在反应④中的作用是:吸收生成的 HCl,促使反应平衡正向移动,有利于提高那格列奈产率。故答案为:吸收生成的 HCl,促使反应平衡正向移动,有利于提高那格列奈产率;
和HCl,反应④是可逆反应,吡啶是一种有机碱,从平衡的角度分析其在反应④中的作用是:吸收生成的 HCl,促使反应平衡正向移动,有利于提高那格列奈产率。故答案为:吸收生成的 HCl,促使反应平衡正向移动,有利于提高那格列奈产率;
(5)满足下列条件的F 的同分异构体①分子中含有苯环和—NH2;②能发生银镜反应,有-CHO或甲酸形成的酯,③1H—NMR谱显示分子中共有四种不同化学环境的氢,沿苯环中心有一个对称轴,所有同分异构体为:
的同分异构体①分子中含有苯环和—NH2;②能发生银镜反应,有-CHO或甲酸形成的酯,③1H—NMR谱显示分子中共有四种不同化学环境的氢,沿苯环中心有一个对称轴,所有同分异构体为:![]() 。
。
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程如下:

⑴Na2Cr2O7可由FeO·Cr2O3先氧化、再酸化得到。其中FeO·Cr2O3发生氧化反应的化学方程式为4FeO·Cr2O3+7O2+20NaOH![]() 8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
⑵“调节pH=4”后,溶液中c(Fe3+)=4×10-8 mol·L-1,则该温度下Ksp[Fe(OH)3]=______。
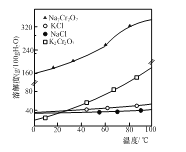
⑶已知部分物质的溶解度曲线如图所示。反应Ⅰ的化学反应类型为______。实验室由质量分数为10%的K2Cr2O7溶液获取K2Cr2O7晶体的方法是______。
⑷为测定K2Cr2O7样品纯度(杂质不参与反应),实验过程为:准确称量一定质量样品,与足量酸性KI 溶液充分反应后,用Na2S2O3标准溶液滴定生成的I2。实验过程中发生的物质转化关系分别为:Cr2O72-![]() Cr3+ S2O32-
Cr3+ S2O32-![]() S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
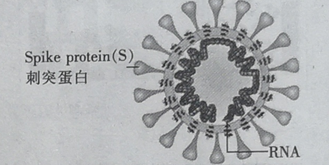
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是
A.0.1 mol L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O ![]() HSˉ+ OHˉ 的平衡常数 K=1×10-7
HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________,阳离子中氮的杂化方式为_____________。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________(填分子式),理由是_________________________________________________________________。
(5)N、O元素第一电离能的大小关系为__________(用元素符号表示),原因为____________。
(6)铜晶体为面心立方最密堆积,配位数为_____________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,列出铜晶体的密度计算式:_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和1/2 mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用右图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系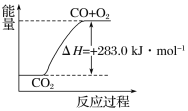
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
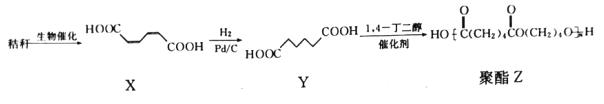
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法将HCl气体直接氧化成Cl2,方程式为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
(1)该反应的平衡常数表达式为___,K(300℃)___K(400℃)(填“<”,“=”或“>”)。
(2)若平衡时a(HCl)为80%,在相同条件下,密闭容器的体积缩小为1L,此反应达平衡时放出的热量(Q)可能是___(填字母序号)kJ。
A.0<Q<58 B.92.8<Q<116 C.371.2<Q<464 D.116<Q<232
(3)在一定条件下,体系中HCl的平衡转化率与L和X的关系如图所示,L和X分别表示温度或压强。

i.X表示的物理量是___。
ii.判断L1与L2的大小关系:L1___L2(填“<”,“=”或“>”)。
(4)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0,反应物HCl的转化率a(HCl)为___(请用P0、P来表示),有利于提高HCl平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com