
 (1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据:
(1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据:| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| ||
| 4min |
| 1.2mol-0.8mol |
| 1.2mol |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
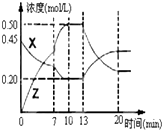 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | |||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是
如图为一种固体离子导体电池与湿润KI试纸AB连接,Ag+可以在RbAg4I5晶体中迁移,空气中氧气透过聚四氟乙烯膜与AlI3反应生成I2,Ag与I2作用形成电池.下列说法中正确的是| A、试纸A端发生还原反应 |
| B、Ag+从银电极移向石墨,K+移向A端 |
| C、试纸B端出现棕色 |
| D、石墨上电极反应式:I2+2e-=2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )| A、原子半径:Z<W<Y<X |
| B、元素Y的氧化物能与NaOH溶液反应 |
| C、最简单气态氢化物的热稳定性:Y<X |
| D、W、Z的氧化物都能与碱反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe→FeCl2→FeCl3→Fe(OH)3 |
| B、Na→Na2O2→Na2CO3→NaHCO3 |
| C、Al→Al2O3→Al(OH)3→AlCl3 |
| D、Na→NaOH→NaHCO3→Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L FeCl3 溶液中含有3NA个Cl- |
| B、常温常压下,22.4L的NO2和CO2合气体含有2NA个O原子 |
| C、标准状况下,2.24L CCl4含有分子的数目为0.1NA |
| D、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com