
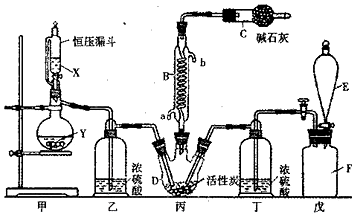
分析 由(3)可知,戊是贮存二氧化硫的装置,则甲装置制备氯气,戊装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥氯气,E中盛放溶液加入戊中排出装置内二氧化硫,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
(1)SO2Cl2遇水能发生剧烈的水解反应,产物之一为氯化氢气体,另外生成物质为硫酸,可知硫元素化合价;
(2)由仪器结构特征可知,仪器E为分液漏斗;SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,说明SO2与氯气之间的反应属于放热反应;
(3)戊是贮存二氧化硫的装置,则E中的试剂是能将二氧硫排出的液体,不能溶解二氧化硫,可以用亚硫酸氢钠溶液,若缺少装置乙和丁,潮湿的氯气和二氧化硫发生氧化还原反应生成 硫酸和氯化氢;
(4)A.甲装置中主要是生成氯气的,可以用二氧化锰和浓盐酸;
B.活性炭有多孔结构可以增大反应物之间的接触面,提高反应速率;
C.冷凝管B为蛇形冷凝管,可用于做垂直式的连续长时间的蒸馏;
(5)根据反应SO2+Cl2=SO2Cl2,可计算出消耗的氯气的体积为896mL即0.04mol时,产生磺酰氯的理论产量,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:由装置可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解.
(1)SO2Cl2遇水能发生剧烈的水解反应,产物之一为氯化氢气体,另外生成物质为硫酸,可知硫元素化合价+6价,
故答案为:+6;
(2)由仪器结构特征可知,仪器E为分液漏斗,仪器C的作用是:吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解,
故答案为:分液漏斗;吸收逸出都有毒的Cl2、SO2,防止空气中的水蒸气进入C,防止污染环境及磺酰氯水解;
(3)戊是贮存二氧化硫的装置,则E中的试剂是能将二氧硫排出的液体,不能溶解二氧化硫,可以用饱和亚硫酸氢钠溶液,若缺少装置乙和丁,潮湿的氯气和二氧化硫发生氧化还原反应生成 硫酸和氯化氢,反应方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:饱和亚硫酸氢钠溶液;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)A.甲装置中主要是生成氯气的,可以用二氧化锰和浓盐酸,故A错误;
B.活性炭有多孔结构可以增大反应物之间的接触面,提高反应速率,故B错误;
C.冷凝管B为蛇形冷凝管,可用于做垂直式的连续长时间的蒸馏,故C正确,
故选C;
(5)氯气的体积为896mL即0.04mol时,根据反应SO2+Cl2=SO2Cl2,产生磺酰氯的理论产量为0.04mol×99.5g/mol=3.98g,所以产率=$\frac{3.3g}{3.98g}$×100%=82.9%,故答案为:82.9%.
点评 本题考查实验制备方案,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,题目涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


科目:高中化学 来源: 题型:实验题

| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com