
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
分析 (1)由表格数据可知,K的沸点低,为774℃;反应时保证Na不能转化为气体;
(2)为了提高原料的转化率,可使平衡正向移动;
(3)从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体性质稳定,不能与Na、K反应;
(4)当反应温度升高到900℃时,Na、K均为气体,结合K为生成物浓度幂之积与反应物浓度幂之积的比解答.
解答 解:(1)工业上制取金属钾的化学原理是化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾),在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃,
故答案为:化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾);774℃;882.9℃;
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的降低温度或移去钾蒸气,
故答案为:当的降低温度或移去钾蒸气;
(3)从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体性质稳定,不能与Na、K反应,只有稀有气体符合,故答案为:d;
(4)当反应温度升高到900℃时,只有Na、K为气体,K=$\frac{c(K)}{c(Na)}$,故答案为:K=$\frac{c(K)}{c(Na)}$.
点评 本题考查化学平衡常数K的意义及平衡移动,为高频考点,把握K与反应的关系、状态与表格中温度的关系为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
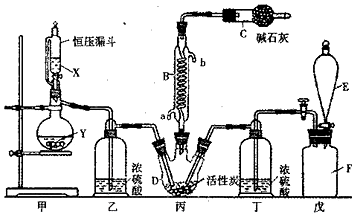
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4 晶体是分子晶体 | |
| B. | C3N4 晶体中微粒间通过离子键结合 | |
| C. | C3N4 晶体中C-N键的键长比金刚石中C-C键的键长要长 | |
| D. | C3N4 晶体中每个C原子连接4个N 原子,而每个N原子连接3个C原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶、玛瑙、红宝石、蓝宝石的主要成分都是非金属氧化物 | |
| B. | 蛋白质是结构复杂的高分子化合物,蛋白质的生物活性首先取决于蛋白质的一级结构 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一,红外光谱法可用于研究有机物分子结构,滴定法不能用于测量盐类物质溶液的浓度 | |
| D. | 丁达尔现象可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
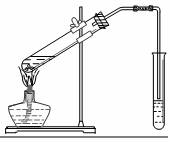 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,该反应的平衡常数为25 | |
| B. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| C. | 200℃时,原平衡中再加入0.4molC,则B的物质的量分数大于25% | |
| D. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com