
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |
分析 由①Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
②2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
结合盖斯定律可知,①-②×$\frac{1}{2}$得到Zn(s)+HgO(s)═ZnO(s)+Hg(l).
解答 解:由①Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
②2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
结合盖斯定律可知,①-②×$\frac{1}{2}$得到Zn(s)+HgO(s)═ZnO(s)+Hg(l),则△H=(-351.1kJ•mol-1)-(-181.4kJ•mol-1)×$\frac{1}{2}$=-260.4kJ•mol-1,
故选D.
点评 本题考查反应热及焓变,为高频考点,把握盖斯定律与已知反应、目标反应的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:多选题
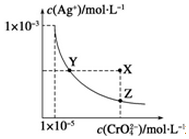 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 | |
| C. | 一定温度下Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | 在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=4.0×1010 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
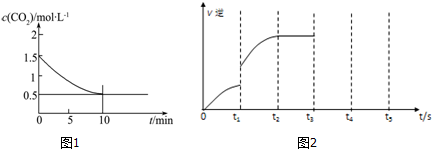
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com