
分析 (1)根据质量守恒定律计算16gA和22gB恰好反应生成C的质量,再根据质量定比关系计算8gA反应需要B的质量,判断A是否过量,再根据不足量的物质利用质量定比关系计算生成C的质量,根据M=$\frac{m}{M}$计算C的摩尔质量,摩尔质量在数值上等于相对分子质量;
(2)二氧化碳和饱和碳酸氢钠不反应,而氯化氢能反应,可用饱和碳酸氢钠溶液除去CO2气体中含有少量HCl杂质;
(3)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$,结合二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子解答;
(4)根据气体的体积和质量列方程式进行计算.
解答 解:(1)16gA恰好能跟22gB完全反应,生成0.25molC和和4.5gD,根据质量守恒,得出C的质量33.5g,C的摩尔质量为$\frac{33.5g}{0.25mol}$=134g/mol,则C相对分子质量为134,
故答案为:134;
(2)二氧化碳和饱和碳酸氢钠不反应,而氯化氢能反应,产生二氧化碳气体,可以用饱和NaHCO3溶液除去二氧化碳中混有的HCl,该方法为洗气,用到的仪器有:广口瓶、双孔塞、导气管,
故答案为:饱和NaHCO3溶液;广口瓶、双孔塞、导气管;洗气;
(3)依据n=$\frac{N}{{N}_{A}}$可知,含有相同分子个数的SO2和SO3,物质的量之比为:1:1;
依据n=$\frac{m}{M}$可知,相同物质的量的物质质量之比等于摩尔质量之比,所以物质的量之比为:1:1的SO2和SO3,质量之比=64:80=4:5;
二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子,则相同物质的量的SO2和SO3,其中所含氧原子个数比为2:3;
故答案为:4:5; 1:1;2:3;
(4)设氧气的物质的量是x,氦气的物质的量是y,则$\left\{\begin{array}{l}{x+y=\frac{5.6}{22.4}}\\{32x+4y=2.4}\end{array}\right.$,
解得:x=0.05mol、y=0.2mol,
相同条件下,氧气和氦气的体积之比等于其物质的量之比=0.05mol:0.2mol=1:4,氧气的质量为:0.05mol×32g/mol=1.6g,
故答案为:1:4;1.6.
点评 本题考查较为综合,涉及物质的分离与提纯、物质的量的计算、化学方程式的计算等知识,题目难度中等,明确物质的量与其它物理量之间的转化关系为解答关键,注意掌握常见物质分离与提纯方法,试题培养了学生的分析能力及化学实验、化学计算能力.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ | |
| D. | 反应放出的热量始终小于92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; ;
;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
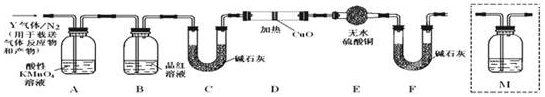
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X2 | W2 | m | |
| 起始浓度/mol•L-1 | 0.4 | 0.4 | 0 |
| 平衡浓度/mol•L-1 | 0.3 | 0.1 | 0.2 |
| A. | 原子半径:W<X<Y | B. | a:b:c=3:1:2 | ||
| C. | X的氧化物一定是无色气体 | D. | m、n、p三种物质均为共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com