
 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
分析 (1)乙醇催化氧化生成乙醛;
(2)①混合物先加密度小的,再加密度大的,最后加乙酸,防止乙酸挥发;
②乙酸、乙醇易溶于水,导气管不插入液面下,可防止倒吸;
③用水替代小试管中的Na2CO3溶液,不能分层;
④分液时使用分液漏斗,乙酸乙酯在碳酸钠溶液的上层;
⑤酯化反应为可逆反应,增大乙醇的量,可促进乙酸的转化;实验a、e中乙酸的量不同.
解答 解:(1)空气中,乙醇蒸气能使红热铜丝保持红热,发生催化氧化反应生成乙醛,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(2)①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸,
故答案为:大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸;
②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止倒吸,故答案为:倒吸;
③不能用水替代小试管中的Na2CO3溶液,理由是乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大,故答案为:不能,乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大;
④分离小试管中的乙酸乙酯,利用分液法,应使用的仪器名称是分液漏斗;分离时,乙酸乙酯应该从仪器上口倒出,故答案为:分液漏斗; 上口倒出;
⑤酯化反应为可逆反应,增大乙醇的量,可促进乙酸的转化,则表中数据X的范围是1.57-1.76mL;实验a、e中乙酸的量不同,则实验a与实验e探究的目的是探究乙酸用量对乙酸乙酯产量的影响,故答案为:1.57-1.76mL;探究乙酸用量对乙酸乙酯产量的影响.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、实验技能、有机物的性质、平衡移动为解答的关键,侧重分析与应用能力的考查,注意混合物分离提纯实验的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X2 | W2 | m | |
| 起始浓度/mol•L-1 | 0.4 | 0.4 | 0 |
| 平衡浓度/mol•L-1 | 0.3 | 0.1 | 0.2 |
| A. | 原子半径:W<X<Y | B. | a:b:c=3:1:2 | ||
| C. | X的氧化物一定是无色气体 | D. | m、n、p三种物质均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
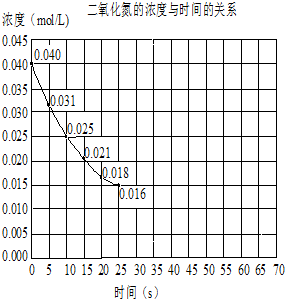
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com