
【题目】下列物质分类中,前者包含后者的是
A.氧化物、化合物B.溶液、胶体
C.化合物、电解质D.酸性氧化物、非金属氧化物
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3mol Cu时,另一个电极上生成的气体在标准状况下的体积是( )
A.5.6L
B.6.72L
C.1.344L
D.11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
回答下列相关问题:
(1)钛的价层电子排布式为______________。
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点 | 1830℃ | 3550℃ | -24.1℃ | 38℃ | 150℃ |
沸点 | 2927℃ | 4827℃ | 136.4℃ | 233.1℃ | 377.2℃ |
晶型 | 离子晶体 | 分子晶体 | |||
表中金刚石的晶型为_________;自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是_____________。
(3)配位数为6,组成为TiCl3·6H2O的晶体有两种:化学式为[TiCl(H2O)5]Cl2·H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3以1:3物质的量比反应生成沉淀,则Y的化学式为___________,Y配离子的空间构型为_________。
(4)钙钛矿是重要的含钛矿物之一,其主要成分Z的晶胞如下图所示:
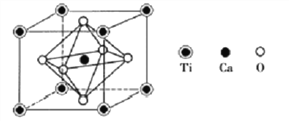
推测Z的化学式为________________。
(5)若晶胞参数a=384.1pm,Z晶体的密度为______g/cm3(已知NA≈6.0×1023;3.8413≈![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼![]() 是一种应用广泛的化工原料。工业上先合成氨气:
是一种应用广泛的化工原料。工业上先合成氨气: ![]()
![]()
![]() ,再进一步制备肼。完成下列填空:
,再进一步制备肼。完成下列填空:
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同):

则生产中适宜选择的催化剂是______(填“A”或“B”或“C”),理由是:______________。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)___________、________________、_______________
![]()
(3)肼可作为火箭燃料, ![]() 在
在![]() 气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:__________________________________________。上述反应中,氧化剂是_____________(写化学式),每1mol
气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:__________________________________________。上述反应中,氧化剂是_____________(写化学式),每1mol![]() 参加反应,转移的电子是________mol。
参加反应,转移的电子是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛有很强的耐酸碱腐蚀能力,可作为潜艇、航天飞船的外衣,下列关于4822Ti的说法正确的是
A. 质子数为22 B. 中子数为48 C. 质量数为70 D. 核外电子数为26
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
A. 2 mol N2和6 mol H2 B. 1 mol N2和2 mol NH3
C. 1 mol N2、3 mol H2和2 mol NH3 D. 2 mol N2、3 mol H2和1 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键 | H-H | C=O | C=C | O-H | C-H |
键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。


(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:

①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com