
����Ŀ����������Ϊ����Խ�����ܱ���Ϊ��δ�����������乤ҵұ���漰���ķ�Ӧ������TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
�ش��������������
��1���ѵļ۲�����Ų�ʽΪ______________��
��2����֪���������۷е�������
���� | ���ʯ | ���ʯ | ���Ȼ��� | ���廯�� | �ĵ⻯�� |
��ѧʽ | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
���� | 1830�� | 3550�� | -24.1�� | 38�� | 150�� |
�е� | 2927�� | 4827�� | 136.4�� | 233.1�� | 377.2�� |
���� | ���Ӿ��� | ���Ӿ��� | |||
���н��ʯ�ľ���Ϊ_________���������������е������ѵ�±�����۷е��������ߵ�ԭ����_____________��
��3����λ��Ϊ6�����ΪTiCl3��6H2O�ľ�������������ѧʽΪ[TiCl(H2O)5]Cl2��H2O��X����ɫ������ʵ�������X��AgNO3��1��2���ʵ����ȷ�Ӧ���ɳ�����Y����ɫ����Y��AgNO3��1��3���ʵ����ȷ�Ӧ���ɳ�������Y�Ļ�ѧʽΪ___________��Y�����ӵĿռ乹��Ϊ_________��
��4�����ѿ�����Ҫ�ĺ��ѿ���֮һ������Ҫ�ɷ�Z�ľ�������ͼ��ʾ��
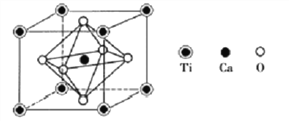
�Ʋ�Z�Ļ�ѧʽΪ________________��
��5������������a=384.1pm��Z������ܶ�Ϊ______g/cm3(��֪NA��6.0��1023��3.8413��![]() )��
)��
���𰸡� 3d24s2 ԭ�Ӿ��� ���Ӿ�����ɺͽṹ����ʱ����Է�������Խ���Ӽ�������Խ�����۷е�Խ�� [Ti(H2O)6]Cl3 �ռ��������� CaTiO3 4.0
�������������������1����ԭ�Ӻ�����22�����ӣ��۵����Ų���3d��4s�������2�����ݽ��ʯ���۵�߷��������Ӿ�����ɺͽṹ����ʱ����Է�������Խ���Ӽ�������Խ�����۷е�Խ������3��Y��AgNO3��1��3���ʵ����ȷ�Ӧ���ɳ�����˵�������3�������ӣ�6��ˮ�����ڽ磻��4�����ݾ�̯ԭ�����Z�Ļ�ѧʽ����5�����ݻ�ѧʽ��֪Z��Ħ��������136g/mol�������������![]() ��
��
��������1����ԭ�Ӻ�����22�����ӣ��۵����Ų���3d��4s������۵����Ų�Ϊ3d24s2����2�����ʯ���۵�������Խ��ʯ��ԭ�Ӿ����� TiCl4��TiBr4��TiI4���Ƿ��Ӿ��������Ӿ�����ɺͽṹ����ʱ����Է�������Խ���Ӽ�������Խ�����۷е�Խ�ߣ�����TiCl4��TiBr4��TiI4���۷е�������������3��Y��AgNO3��1��3���ʵ����ȷ�Ӧ���ɳ�����˵�������3�������ӣ�6��ˮ�����ڽ磬Y�Ļ�ѧʽΪ[Ti(H2O)6]Cl3��Y�����ӵĿռ乹��Ϊ�ռ�������������4�����ݾ�̯ԭ����ÿ����������Tiԭ������![]() =1������Caԭ����1������Oԭ������
=1������Caԭ����1������Oԭ������![]() ����Z�Ļ�ѧʽ��CaTiO3����5�����ݻ�ѧʽ��֪Z��Ħ��������136g/mol�������������
����Z�Ļ�ѧʽ��CaTiO3����5�����ݻ�ѧʽ��֪Z��Ħ��������136g/mol�������������![]() ����
����![]() g/cm3��
g/cm3��


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag+��aq��+Cu��s���TCu2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ����ش��������⣺ 
��1���缫X�IJ����� �� �������ҺY����
��2�����缫Ϊ��ص����������ĵ缫��ӦΪ X�缫�Ϸ����ĵ缫��ӦΪ ��
��3�����·�еĵ����Ǵ��缫�����缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ������������������Դ���õȽǶȷ���������˵����ȷ���ǣ� ��
A.̫���ܡ����ܡ���Ȼ�����������ܶ��ǿ�������Դ
B.ˮú����һ�ֶ�����Դ����úֱ��ȼ����ȾС
C.�о���ú�������¼�����Ŀ�ľ�����߲��������㹤ҵ��������Ҫ
D.����������������Դ��Ŀǰ���������䷽�㡢��ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ںϳɻ��ʣ���ũҵ��Ӧ�ù㷺�����й��ڰ������ʵ���������ȷ����
A. ��ɫ B. ������ C. �ܶȱȿ���С D. ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���黯ըҩ����ˮ�Ĵ�������Ӱ���ƷƷ����Karl Fischer���Dzⶨ������ˮ�������÷������÷���������I2��SO2��Ӧ��������ˮ��Ϊԭ�����ݴ˻ش�����������
��1��д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��_______________________��
��ͼ��ijͬѧ��ʵ����ģ��Karl Fischer����ʵ��װ��ͼ��

��2��ʵ�鿪ʼʱ����Dװ���м���10.00���黯ըҩ��Ʒ��10.16��I2(��֪I2����)��������ֹˮ�У���װ���ڲ�ͨ��N2����Ŀ����_______________________��
��3���ر�ֹˮ��K1����Һ©�����������������ر�����ַ�Ӧ����A������SO2�������ر�K2����ʱB��������_______________________��B�ڷ�Ӧ�����л�����������___________________________��
��4����Ӧ������Dװ��ȡ������N2����ʣ��SO2�������ˮ���250.00mL��Һ��ȡ25.00mL��0.20mol��L-1Na2S2O3��Һ�ζ�ʣ��I2��������֪��Ӧ������2S2O32-+I2=S4O62-+2I-�����ʵ��ƽ��������Na2S2O32��Һ20.00mL����ԭ�黯ըҩ��ˮ�ĺ���Ϊ_________(��ٷֱ�)��
��5�����ڵζ������в�С�Ľ���Һ����ȥ���Σ���ˮ�����ⶨ�����____________(����ƫ�������� ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊ�����ӵ�������������������ȷ���ǣ� ��
Ϊ�����ӵ�������������������ȷ���ǣ� ��
A. ���³�ѹ�£�46g![]() ��
��![]() ������干��3
������干��3![]() ��ԭ��
��ԭ��
B. ��״���£�22.4L�״��к��е���ԭ����ĿΪ1.0![]()
C. 100��ʱ��1L pH=6�Ĵ�ˮ�У����е�![]() ��ĿΪ
��ĿΪ![]()
![]()
D. ������0.1mol![]() �����ϡNaOH��Һ��Ӧ��ת�Ƶĵ�������Ϊ0.2
�����ϡNaOH��Һ��Ӧ��ת�Ƶĵ�������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ����У�ǰ�߰������ߵ���
A.�����������B.��Һ������
C.����������D.����������ǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��d��e��fΪ����ԭ��������������ǰ20������Ԫ�أ�a��b��c��dλ��ͬ���ڣ�b��fλ��ͬ���壬����a��b��f Ϊ����Ԫ�أ�c���������������������������3����c��f ��ԭ����������e��2��������˵���������
A. ԭ�Ӱ뾶a>b>c>d
B. �����̬�⻯����ȶ���e<c<d
C. ����������Ӧ��ˮ����ļ���f>b
D. fc2��ec2���ֻ�������c�Ļ��ϼ���ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com