
【题目】乳化炸药中微量水的存在严重影响产品品质,Karl Fischer法是测定其中微量水含量常用方法,该方法是利用I2和SO2反应定量消耗水作为原理,据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)实验开始时,向D装置中加入10.00克乳化炸药样品和10.16克I2(已知I2过量),打开所有止水夹,向装置内部通入N2,其目的是_______________________。
(3)关闭止水夹K1,打开分液漏斗活塞,加入硫酸后关闭,充分反应后,A中仍有SO2产生,关闭K2,此时B的作用是_______________________。B在反应过程中还能起到的作用是___________________________。
(4)反应后,将D装置取下,用N2赶走剩余SO2后加适量水配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-,多次实验平均与消耗Na2S2O32溶液20.00mL,则原乳化炸药中水的含量为_________(填百分比)。
(5)若在滴定过程中不小心将标准液洒出去几滴,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。
【答案】 SO2+I2+2H2O=2HI+H2SO4 赶走装置内部的空气,防止空气中O2和水蒸气对实验的影响 临时储气装置 平衡装置内部大气压 7.2% 偏低
【解析】试题分析:(1).I2和SO2、H2O反应生成硫酸和氢碘酸;(2)向装置内部通入N2,可以赶走装置内部的空气;(3)关闭K2,A中生成的二氧化硫储存在B中;B中的长颈漏斗与空气相连,可以起到平衡装置内部大气压的作用;(4)25.00mL溶液消耗Na2S2O3溶液20.00mL,则250.00mL溶液消耗Na2S2O3溶液200.00mL,根据二氧化硫、Na2S2O3共消耗10.16克I2计算水的含量;(5)若在滴定过程中不小心将标准液洒出去几滴,消耗Na2S2O3溶液的体积偏大,与水反应的碘偏少;
解析:(1).I2和SO2、H2O反应生成硫酸和氢碘酸,反应方程式是SO2+I2+2H2O=2HI+H2SO4;(2)向装置内部通入N2,可以赶走装置内部的空气,防止空气中O2和水蒸气对实验的影响;(3)关闭K2,A中生成的二氧化硫储存在B中,所以B的作用是临时储气装置;B中的长颈漏斗与空气相连,可以起到平衡装置内部大气压的作用;(4)根据以上分析,则250.00mL溶液消耗Na2S2O3溶液200.00mL,根据2S2O32-+I2=S4O62-+2I-,Na2S2O3消耗碘单质的物质的量为![]() ,二氧化硫、Na2S2O3共消耗10.16克I2,SO2+I2+2H2O=2HI+H2SO4反应消耗碘单质的物质的量为
,二氧化硫、Na2S2O3共消耗10.16克I2,SO2+I2+2H2O=2HI+H2SO4反应消耗碘单质的物质的量为![]() ,SO2+I2+2H2O=2HI+H2SO4反应消耗水的物质的量是0.04mol,原乳化炸药中水的含量为
,SO2+I2+2H2O=2HI+H2SO4反应消耗水的物质的量是0.04mol,原乳化炸药中水的含量为![]() ;(5)若在滴定过程中不小心将标准液洒出去几滴,消耗Na2S2O3溶液的体积偏大,与水反应的碘偏少,所以水含量测定结果将偏低。
;(5)若在滴定过程中不小心将标准液洒出去几滴,消耗Na2S2O3溶液的体积偏大,与水反应的碘偏少,所以水含量测定结果将偏低。


科目:高中化学 来源: 题型:
【题目】下列物质的沸点按由高到低的顺序排列正确的是
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③B.④②①③C.④③②①D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

已知:①![]() ;②
;② 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成生物体的化学元素的特点是( )
A. 种类大体相同,含量有差异 B. 种类不同,含量大体相同
C. 种类和含量都相同 D. 种类和含量都不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
回答下列相关问题:
(1)钛的价层电子排布式为______________。
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点 | 1830℃ | 3550℃ | -24.1℃ | 38℃ | 150℃ |
沸点 | 2927℃ | 4827℃ | 136.4℃ | 233.1℃ | 377.2℃ |
晶型 | 离子晶体 | 分子晶体 | |||
表中金刚石的晶型为_________;自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是_____________。
(3)配位数为6,组成为TiCl3·6H2O的晶体有两种:化学式为[TiCl(H2O)5]Cl2·H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3以1:3物质的量比反应生成沉淀,则Y的化学式为___________,Y配离子的空间构型为_________。
(4)钙钛矿是重要的含钛矿物之一,其主要成分Z的晶胞如下图所示:
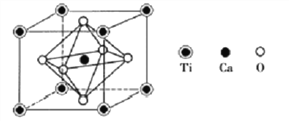
推测Z的化学式为________________。
(5)若晶胞参数a=384.1pm,Z晶体的密度为______g/cm3(已知NA≈6.0×1023;3.8413≈![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色的固体物质。描述正确的是( )
A.①②B.①②③C.④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼![]() 是一种应用广泛的化工原料。工业上先合成氨气:
是一种应用广泛的化工原料。工业上先合成氨气: ![]()
![]()
![]() ,再进一步制备肼。完成下列填空:
,再进一步制备肼。完成下列填空:
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同):

则生产中适宜选择的催化剂是______(填“A”或“B”或“C”),理由是:______________。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)___________、________________、_______________
![]()
(3)肼可作为火箭燃料, ![]() 在
在![]() 气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:__________________________________________。上述反应中,氧化剂是_____________(写化学式),每1mol
气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:__________________________________________。上述反应中,氧化剂是_____________(写化学式),每1mol![]() 参加反应,转移的电子是________mol。
参加反应,转移的电子是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
A. 2 mol N2和6 mol H2 B. 1 mol N2和2 mol NH3
C. 1 mol N2、3 mol H2和2 mol NH3 D. 2 mol N2、3 mol H2和1 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com