
根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
①Cl2+2KI=I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
| A.Cl2>I2>Fe3+>SO24- | B.Cl2>Fe3+>I2>SO24- |
| C.Fe3+>Cl2>I2>SO24- | D.Cl2>Fe3+>SO24->I2 |
B
解析试题分析:在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,据此可以判断。反应Cl2+2KI=I2+2KCl中氯气是氧化剂,单质碘是氧化产物,则氧化性强弱顺序是Cl2>I2;在反应2FeCl3+2HI=I2+2FeCl2+2HCl中氧化剂是氯化铁,氧化产物是单质碘,则氧化性强弱顺序是Fe3+>I2;反应2FeCl2+Cl2=2FeCl3中氯气是氧化剂,氯化铁是氧化产物,则氧化性强弱顺序是Cl2>Fe3+;反应I2+SO2+2H2O=2HI+H2SO4中氧化剂是单质碘,氧化产物是硫酸,所以氧化性强弱顺序是I2>SO24-,故氧化性强弱顺序是Cl2>Fe3+>I2>SO24-,答案选B。
考点:考查氧化性强弱顺序比较


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为2∶1时,则反应中Cu2S与被还原的HNO3的物质的量之比为( )
| A.1∶6 | B.1∶7 | C.1∶8 | D.1∶9 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2Fe(OH)3+3Cl2+10KOH2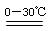 K2FeO4+KCl+8H2O
K2FeO4+KCl+8H2O
对于该反应,下列说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生还原反应 | D.Cl2是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
| A.+4 | B.+5 | C.+6 | D.+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O
在这一过程中,每制取l mol I2时,所消耗氧化剂的质量是( )
| A.28g | B.16g | C.329 | D.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列氧化还原反应中,水作为氧化剂的是( )
A.CO+H2O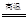 CO2+H2 CO2+H2 | B.Cl2+H2O=HCl+HClO |
| C.2Na2O2+2H2O=4NaOH+O2↑ | D.2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对剧毒的氰化物可在碱性条件下用如下方法进行处理:
2CN- +8OH-+5Cl2= 2CO2 +N2 +10Cl- +4H2O 下列判断正确的是
| A.当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:Cl-> CN- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,主要由于维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com