
【题目】室温下进行相关实验。下列结论正确的是
A.向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+c(CO32-)
B.向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-)
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13
D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-)
【答案】C
【解析】
试题分析:A.向NaHCO3溶液中通CO2至pH=7,c(H+)=c(OH-),结合电荷守恒可知:c(Na+)=c(HCO3-)+2c(CO32-),故A错误;B.向CH3COONa溶液中加入等浓度等体积的盐酸,钠离子和氯离子的物质的量相等,则:c(Na+)=c(Cl-),故B错误;C.向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液,设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:![]() =0.05mol/L<0.1mol/L,溶液的pH<13,故C正确;D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中,c(Cl-)基本不变,约为0.1mol/L,c(Ag+)=Ksp(AgCl)/c(Cl-)≠c(Cl-),故D错误;故选C。
=0.05mol/L<0.1mol/L,溶液的pH<13,故C正确;D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中,c(Cl-)基本不变,约为0.1mol/L,c(Ag+)=Ksp(AgCl)/c(Cl-)≠c(Cl-),故D错误;故选C。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为
(1)有机物Y是X的同分异构体,且属于芳香烃, Y在一定条件能发生聚合反应,写出其化学方程式____________________________________________ 。
(2)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有___________ 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学】有机物A→F有如下转化关系: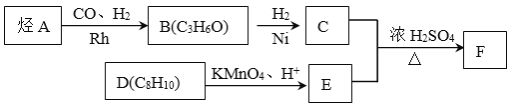
已知:①
②核磁共振氢谱显示C的分子中含有4种不同化学环境的氢原子,且峰面积之比为3:2:2:1。
③F是酯类化合物,分子中苯环上的一溴代物只有两种。
(1)A的分子式是 ,主要用途是 (写一种)。
(2)检验B中官能团的常用方法是 。
(3)D物质的名称为 。
(4)C+E→F的化学方程式是 。
(5)X与E互为同分异构体,且X有下列性质,符合条件的X有 种。
①接触NaHCO3有二氧化碳气体产生。
②与银氨溶液共热有银镜现象。
③1摩尔X与足量钠反应有1摩尔气体产生。
(6)Y与E也互为同分异构体,属于酯类化合物,分子中只含一种官能团,且苯环上的一硝基取代物只有一种,则Y的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是合成有机高分子材料W的流程图:

已知: 
回答下列问题:(1)B的结构简式:____ ____
(2)E中所含官能团的结构简式:
(3)B→C反应类型为_ _____ __
(4)写出下列反应的化学方程式:
D+E→W:___________ __
C与银氨溶液反应:___________ ___
(5)满足以下条件的E的同分异构体有 种
① 可发生银镜反应 ② 可与NaHCO3溶液生成CO2 ③能与FeCl3溶液反应显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如下:

实验原理为:

实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min。
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌。
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜)配成的溶液25ml装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min。
④再从仪器a加入25mL无水乙醚搅拌。
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液。
⑥蒸发橙黄色溶液,得二茂铁粗产品。
⑦……
回答下列问题:
(1)步骤①中通入氮气的目的是: 。
(2)仪器c的名称为: ,其适宜容积应为: 。
a.100ml b.250ml c.500ml
(3)仪器d使用前应进行的操作是: ,请简述该过程: 。
(4)步骤⑦是二茂铁粗产品的提纯,该过程在下图中进行,其操作名称为: 。

(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是 。
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是

A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是____________。
②已知:
2Cu(s)+1/2O2(g)═Cu2O(s)△H=-169kJmol-1,
C(s)+1/2O2(g)═CO(g)△H=-110.5kJmol-1,
Cu(s)+1/2O2(g)═2CuO(s)△H=-157kJmol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu20(s)+CO(g); △H=____________kJ/mol。
(2)氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4.
该反应每转移3mol电子,生成CuH的物质的量为____________。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。

①当c(Cl-)=9molL-1时,溶液中主要的3种含铜物种浓度大小关系为____________。
②在c(Cl-)=1molL-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为____________(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为____________,(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3L-3)
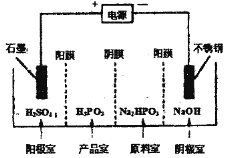
②电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
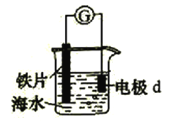
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com