
����Ŀ����ï��������ȼ�ϵĽ������̼����������ȡ�ʵ�����Ʊ���ï��װ��ʾ��ͼ���£�

ʵ��ԭ��Ϊ��

ʵ�鲽��Ϊ��
����������ƿ�м���25g��ĩ״��KOH����������a�м���60mL��ˮ���ѵ���ƿ�У���ֽ��裬ͬʱͨ����Լ10min��
���ٴ�����a����5.5mL������Ļ����ϩ(�ܶ�0.95g/cm3)�����衣
����6.5g��ˮFeCl2��(CH3)2SO(��������)��ɵ���Һ25mlװ������a�У�������������c�У�45min���꣬��������45min��
���ٴ�����a����25mL��ˮ���ѽ��衣
����c�е�Һ��ת������d�����������ᡢˮ��ϴ�����Σ���Һ�óȻ�ɫ��Һ��
�������Ȼ�ɫ��Һ���ö�ï���ֲ�Ʒ��
�ߡ���
�ش��������⣺
��1����������ͨ�뵪����Ŀ���ǣ� ��
��2������c������Ϊ�� ���������ݻ�ӦΪ�� ��
a��100ml b��250ml c��500ml
��3������dʹ��ǰӦ���еIJ����ǣ� ��������ù��̣� ��
��4���������Ƕ�ï���ֲ�Ʒ���ᴿ���ù�������ͼ�н��У����������Ϊ�� ��

��5��Ϊ��ȷ֤�õ����Ƕ�ï��������Ҫ���е�һ���ʵ���� ��
��6�����յõ������Ķ�ï��3.7g�����ʵ��IJ���Ϊ (������λ��Ч����)��
���𰸡���1����װ���еĿ����ž�����ֹʵ�������Fe2����������2��������ƿ�� b
��3����©���رշ�Һ©���������������Һ©����ע������������ˮ���۲������Ƿ�©ˮ������©ˮ���ر���ĥ����������������Ƿ�©ˮ������©ˮ������������ĥ������ת180�ȣ�����������Ƿ�©ˮ
��4��������5���ⶨ���ù�����۵���6��50%
��������
�����������1����Ӧ�����е��������ӣ����ױ������е����������������Ҫͨ�뵪�����Գ�ȥװ���еĿ������ʴ�Ϊ����װ���еĿ����ž�����ֹʵ�������Fe2����������
��2������cΪ������ƿ��ʹ��ʱҺ������Ӧ�����ݻ���![]() ~
~![]() ����ѡb���ʴ�Ϊ��������ƿ��b��
����ѡb���ʴ�Ϊ��������ƿ��b��
��3��������Һ©��ǰӦ���ȶԷ�Һ©�����м�©���ʴ�Ϊ����©���رշ�Һ©���������������Һ©����ע������������ˮ���۲������Ƿ�©ˮ������©ˮ���ر���ĥ����������������Ƿ�©ˮ������©ˮ������������ĥ������ת180�ȣ�����������Ƿ�©ˮ
��4������ͼʾ���������Ƕ�ï���ֲ�Ʒ���ᴿ���ù��̽��������ʴ�Ϊ��������
��5��������4����֪����ï�����ڷ��Ӿ��壬��˲ⶨ���ù�����۵㼴��ȷ�����ɵ������Ƿ��Ƕ�ï�����ʴ�Ϊ���ⶨ���ù�����۵�
��6�����뷴Ӧ��KOH������Ϊ25g����ˮFeCl2������Ϊ6.5g�������ϩ������Ϊ0.95g/cm3��5.5mL=5.225g�����ݷ���ʽ��֪�������ϩ��ȫ��Ӧ�������ϵõ���ï��������Ϊ![]() ��5.225g=7.3625g����ʵ��IJ���Ϊ
��5.225g=7.3625g����ʵ��IJ���Ϊ![]() ��100%=50%���ʴ�Ϊ��50%
��100%=50%���ʴ�Ϊ��50%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������ij�������Դ�A�뷼���廯����C7H8OΪ����ԭ�ϣ�������������������Ƶ�һ����Ҫ��Һ�����ϵ��м���Z��
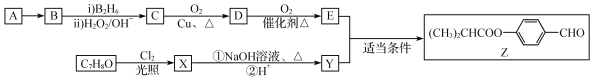
��֪���� RCH=CH2![]() RCH2CH2OH��
RCH2CH2OH��
��һ��̼ԭ������2����OHʱ���Զ���ˮ�γ��ʻ���
��1��A ��B�ķ�Ӧ����Ϊ_______________��C7H8O ��X�ķ�Ӧ������___________��
��2��D�й���������Ϊ__________��B������Ϊ___________��C�Ľṹ��ʽΪ_________��
��3��д��X��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_________________________________________��
��4��C7H8Oת��ΪY�����пɵõ�һ����Է���������Y��16�ĸ���ƷW��W�ж���ͬ���칹�壬��������������ͬ���칹�干��________�֣�д�����к˴Ź���������4�������ʵ�ͬ���칹��ṹ��ʽ_________________��д�����ּ�������
������FeCl3��Һ������ɫ��Ӧ�����ܷ���������Ӧ��
��5�������������̣�д����![]() Ϊ����ԭ�Ϻϳɱ���ȩ�ĺϳ�·��ͼ______________________________________________________��
Ϊ����ԭ�Ϻϳɱ���ȩ�ĺϳ�·��ͼ______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��1���㽭��ѧ�ü״���CO��O2�ڳ�ѹ��ij�¶Ⱥʹ����������ºϳ�̼���������DMC�����о�������
��֪������ CO��ȼ���ȣ���H=-283.0 kJmol-1��
����1mol H2O(l)��ȫ�������H2O(g)������44 kJ��������
����2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+H2O(g) ��H=��15.5 kJmol-1
CH3OCOOCH3 (g)+H2O(g) ��H=��15.5 kJmol-1
��2CH3OH(g)+CO (g)+ 1/2O2(g) ![]() CH3OCOOCH3 (g)+H2O(l) ��H= ���÷�Ӧƽ�ⳣ��K�ı���ʽΪ�� ��
CH3OCOOCH3 (g)+H2O(l) ��H= ���÷�Ӧƽ�ⳣ��K�ı���ʽΪ�� ��
��2���״�Ҳ���Ʊ������һ����Ҫԭ�ϡ�ij�¶�ʱ����10mol����������ˮ����Һ�Լ��ԣ������Һ�еμ�1LijŨ�ȵļ��ᣬʹ��Һ�����ԣ���μӼ���Ĺ�����ˮ�ĵ���ƽ�⽫_____________(�������������) �ƶ�, ��������Һ������Ũ���ɴ�С��˳��Ϊ�� ��
���״���CO2��ֱ�Ӻϳ�DMC��2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+ H2O(g)�����״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ��������
CH3OCOOCH3 (g)+ H2O(g)�����״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ��������
��1���ں����ܱ������з���������Ӧ����˵����Ӧ�ﵽƽ��״̬���� ��ѡ���ţ���
A��2v��(CH3OH)=v��(CO2) B��CH3OH��H2O�����ʵ���֮�ȱ��ֲ���
C��������������ܶȲ��� D��������ѹǿ����
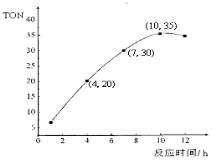
��2��ij�о�С����ij�¶��£���100mL�����ܱ�������Ͷ��2.5 mol CH3OH(g)������CO2��6��10-5 mol�������о���Ӧʱ��Լ״�ת����(TON)��Ӱ�죬��仯������ͼ��ʾ�����㹫ʽΪ��TON = ת���ļ״������ʵ���/���������ʵ������ڸ��¶��£���ѷ�Ӧʱ���� ��4��10 h��̼���������ƽ����Ӧ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����ѧ��Ӧ���ʺͻ�ѧ��Ӧ�ȵ��й����⣬ij�о�С�����������ʵ��
��.��H2O2�ķֽⷴӦΪ�о�����ʵ�鷽�������ݼ�¼���±���t��ʾ�ռ�a mL O2�����ʱ�䡣
��� | ��Ӧ �¶�/�� | c(H2O2)/ mol��L��1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
��1�����ʵ��2��ʵ��3��Ŀ�����о�________________________�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2��Ϊ�о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���Խ�ʵ��________��ʵ��________(�����)���Աȡ�
��3����ʵ��1��ʵ��2���Աȣ�t1________t2(�����������������)��
��.��KI��FeCl3��ӦΪ��(2Fe3����2I��===2Fe2����I2)���ʵ�飬̽���˷�Ӧ����һ�����ȡ���ѡ�Լ�����0.1 mol��L��1 KI��Һ ��0.1 mol��L��1 FeCl3��Һ
��0.1 mol��L��1 FeCl2��Һ ��0.1 mol��L��1 ����
��0.1 mol��L��1 KSCN��Һ ��CCl4
ʵ�鲽�裺��1��ȡ5 mL 0.1 mol��L��1 KI��Һ���ٵμӼ���0.1 mol��L��1 FeCl3��Һ
��2����ַ�Ӧ����Һ�ֳ�����
��3��ȡ����һ�ݣ����Լ��ޣ���CCl4������ɫ��˵����Ӧ���ɵ�
��4����ȡһ�ݣ����Լ�________(�����)������________________________��˵���˷�Ӧ����һ�����ȡ�
��.N2O4�ɷֽ�ΪNO2����100 mL�ܱ�������Ͷ��0.01 mol N2O4�������ִ���ѧʵ�鼼�����ٲ���c(NO2)��c(NO2)��ʱ��仯�����ݼ�¼����ͼ��ʾ��
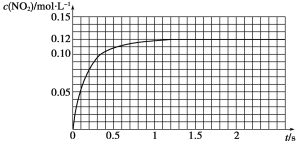
��1����Ӧ���������ʣ���������________________������N2O4�����ʵ���Ϊ________mol��
��2��c(NO2)��ʱ��仯�����߱�����ʵ���õĻ�ѧ��Ӧ��������С���ӿ�ʼ��ƽ�⽨�����ʱ���ƽ����Ӧ����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��A��D��Ԫ�����ڱ��ж����ڵ�����Ԫ�أ�����ݱ�����Ϣ�ش���������
Ԫ�� | ���ʻ�ṹ��Ϣ |
A | �����Ƴɵĸ�ѹ�ƣ������Ļƹ�����ǿ�����Զ�����䵥��ȼ�պ����ɵ���ɫ���� |
B | ��ҵ��ͨ������Һ̬��������䵥�ʡ�ԭ�ӵ��������������ڲ����������2.5�� |
C | ������˫ԭ�ӷ��ӣ����¡���ѹ���ǵ�����ɫ���壬ԭ�ӵ�L��������һ�����Ӽ��ﵽ�ȶ��ṹ |
D | +2�������ӵĺ�������Ų�����ԭ����ͬ |
��1���ϱ�����A����ͬһ���ڵ�Ԫ���ǣ�дԪ�ط��ţ�_____ ��
����D���ӵĽṹʾ��ͼ__________________ ��
��2����֪C�ĵ�������H2O�����û���Ӧ����O2��д��C������ˮ��Ӧ�Ļ�ѧ����ʽ_ ��
��3����Ԫ��B�ĵ��ʻ���������ȷ���� _��
a��BԪ�ص��������Ϊ+6 b�����¡���ѹ�µ���������ˮ
c�����ʷ����к���18������ d����һ���������������뵥��B��Ӧ
��4��A��D��Ԫ�ػ����Խ�ǿ���ǣ�дԪ�����ƣ� _____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½������ʵ�顣���н�����ȷ����
A����NaHCO3��Һ��ͨCO2��pH=7��c(Na+)=c(HCO3-)+c(CO32-)
B����CH3COONa��Һ�м����Ũ�ȵ���������c(Na+)��c(Cl-)
C����Ũ��Ϊ0.1mol/LNaHSO4��Һ�м����Ũ�ȵ������Ba(OH)2��Һ��pH��13
D����0.1molAgClͶ�뵽100mL0.1mol/LNaCl��Һ�У�c(Ag+)=c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g)��H1=��99kJ.mol-1��
CH3OH(g)��H1=��99kJ.mol-1��
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��H2=��58kJ.mol-1
CH3OH(g)+H2O(g)��H2=��58kJ.mol-1
��CO2(g)+H2(g)![]() CO(g)+H2O(g)��H3
CO(g)+H2O(g)��H3
�ش��������⣺
��1��д��CO2�Ľṹʽ__________��
��2�����������ݼ������H3=kJ.mol-1
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£��¶�T1��T2�Է�Ӧ��Ӱ�죬������ȷ����__________(�����)

���¶�ΪT1ʱ���ӷ�Ӧ��ƽ�⣬���ɼ״���ƽ������Ϊ:v(CH3OH)=nA/tAmol/(L��min)
���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
��������1mol�״���ͬʱ������1molCO2��˵����Ӧ�ﵽƽ��
������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱn(H2)��n(CH3OH)��ֵ����
��4����T1�¶�ʱ����2molCO2��6molH2����һ�ܱպ������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊ50%�����������ڵ�ѹǿ����ʼѹǿ֮��Ϊ__________�����¶������£���Ӧƽ�ⳣ��Ϊ__________(��������)
��5����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ�����ԣ������ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ-ѡ��2����ѧ�뼼��]̼���Ƶ���;�ܹ㣬������ұ�𡢷�֯��ƯȾ�ȹ�ҵ�Ļ���ԭ�ϡ����������ش��������⣺
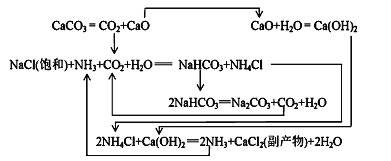
���������繤ҵ����̼���Ƶķ�����·������N.Leblanc���������������£�
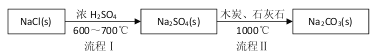
��1������I����һ������____�����̢�ķ�Ӧ�ֲ����У�a. ![]()
b.Na2S��ʯ��ʯ�������ֽⷴӦ���ܷ�Ӧ����ʽ�ɱ�ʾΪ__________________��
��1862�꣬����ʱ������ά��ErnestSolvay���ð������̼���ơ���Ӧԭ�����£�
20��ʱһЩ������ˮ�е��ܽ��/g(100gH2O)
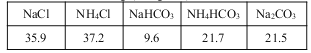
��2��������ɴ����ԭ����____________����ѭ�����õ�������____________��
��3������NaCl��ҺͨNH3��CO2������NaHCO3��ԭ���У�_________��__________��_________��
���ҹ�����ר�Һ�°��о��������Ƽ���䷴Ӧԭ���Ͱ�����ƣ������ư����Ƽ����ϣ������ԭ
�������ʡ�
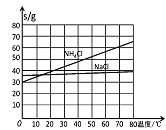
��4����������������NaHCO3�����õ���Һ�м���NaCl���岢ͨ��NH3����________�����¶ȷ�Χ��������________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��п��ϡ����ķ�Ӧ����������ԭ��Ӧ������ ��Ӧ������������������������ʵ���ҿɽ��÷�Ӧ��Ƴ�ԭ��أ�Ӧ���� ��Ϊ�������ϣ������ĵ缫��ӦʽΪ ������1mol�����������ߣ����������������������ڱ�״���µ������ L��
II��ijͬѧ����ϡ������п��ȡ������ʵ���У����ּ�����������ͭ��Һ�ɼӿ��������������ʡ���ش��������⣺
��1������ͭ��Һ���Լӿ������������ʵ�ԭ���� ��
��2��ʵ����������Na2SO4��MgSO4��Ag2SO4��K2SO4��4����Һ������ʵ����CuSO4��Һ���������õ��� ��
��3��Ҫ�ӿ�����ʵ����������������ʣ����ɲ�ȡ�Ĵ�ʩ�� �������֣���
��4��Ϊ�˽�һ���о�����ͭ�����������������ʵ�Ӱ�죬��ͬѧ���������һϵ��ʵ�顣�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���ķ�Ӧƿ�У��ռ����������壬��¼�����ͬ�������������ʱ�䡣
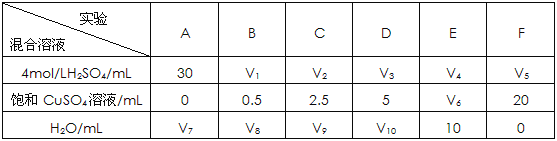
������ɴ�ʵ����ƣ����У�V1= ��V6= ��V9= ��
�ڸ�ͬѧ���ó��Ľ���Ϊ������������CuSO4��Һʱ���������������ʻ�����ߡ����������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com