
【题目】对于密闭容器中的可逆反应:4L(g)![]() 2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指
2M(g)+N(g) △H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示。图中y轴是指

A. 气体混合物的平均相对分子质量 B. 气体混合物的总物质的量浓度
C. L在气体混合物的体积分数 D. 气体混合物的密度
【答案】A
【解析】试题分析:根据反应的方程式可知,该反应是体积减小的吸热的可逆反应,因此升高温度或增大压强平衡向正反应方向移动。根据图像可知随着温度升高和压强的增大,Y逐渐增大。A、混合气的平均相对分子质量等于混合气的质量与混合气总物质的量的比值,升高温度或增大压强平衡向正反应方向移动,在反应过程中混合气质量不变,但混合气的物质的量减小,因此气体混合物的平均相对分子质量逐渐增大,A正确;B、升高温度或增大压强平衡向正反应方向移动,在反应过程中混合气的物质的量减小,因此气体混合物的总物质的量浓度逐渐减小,B不正确;C、升高温度或增大压强平衡向正反应方向移动,所以L在气体混合物的体积分数减小,C不正确;D、升高温度或增大压强平衡向正反应方向移动,在反应过程中混合气质量和容器容积均不变,因此气体混合物的密度始终不变,D不正确,答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2O![]() HCl+HClO,光照后,溶液颜色变浅
HCl+HClO,光照后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取较低的温度
C.用饱和食盐水除去Cl2中的HCl
D.反应2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A. BaCO3能与盐酸反应,可用于治疗胃酸过多
B. MgO熔点高,可用作耐高温材料
C. SO2具有氧化性,可用于漂白品红、织物等
D. NH3极易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图所示,a、b为惰性电极。利用该装置可将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的。下列说法不正确的是( )
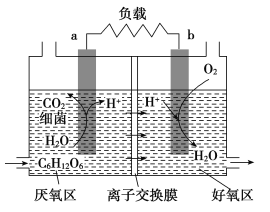
A.a为负极,电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
B.反应过程中产生的质子透过离子交换膜扩散到好氧区
C.装置中的离子交换膜是阳离子交换膜
D.该装置可把电能转化为生物质能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置制取氯水并进行相关实验。
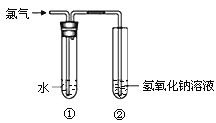
(1)装置②中反应的化学方程式是 ;
(2)取少量装置①中的溶液滴在蓝色石蕊试纸上,试纸先变红后褪色,说明氯水具有的性质是 ;
(3)实验室常用NaOH溶液吸收多余的氯气,下列试剂也可用于吸收氯气的是 (填字母);
a.饱和NaCl溶液 b.蒸馏水 c.Na2SO3溶液
(4)欲验证Cl2的氧化性强于I2,取少量装置①中的溶液加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
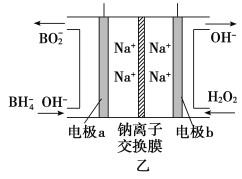
【题目】高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知Na2FeO4在强碱性溶液中会析出沉淀。其生产工艺流程如图所示:
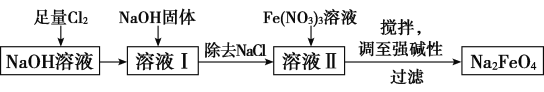
(1)写出向NaOH溶液中通入足量Cl2发生反应的离子方程式:_________________________。
(2)向溶液Ⅱ中加入Fe(NO3)3溶液发生反应,该反应的氧化剂是____________,每制得49.8 g Na2FeO4,理论上消耗氧化剂的物质的量为____________mol。
(3)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图甲所示。
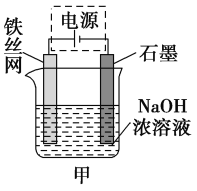
①电解过程中阳极的电极反应式为_______________________。
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图乙所示。工作过程中该电源的正极反应式为________________________,Na+由____________(填“a”或“b”,下同)极区移向____________极区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
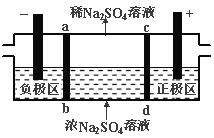
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O-4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性,充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是( )
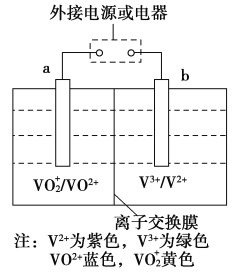
A.充电时,b极接直流电源正极,a极接直流电源负极
B.充电过程中,a极的电极反应式为:VO![]() +2H++e-=VO2++H2O
+2H++e-=VO2++H2O
C.放电时,H+从左槽迁移进右槽
D.放电过程中,左槽溶液颜色由黄色变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧的热化学方程式,可用下列两种方程式表示:
①2H2(g)+O2(g)=2H2O(l)+Q1kJ
②H2(g)+1/2O2(g)=H2O(g)+Q2kJ
Q1与Q2的关系为
A .Q1= Q2 B.Q2 >Q1 C.Q1>2Q2 D.Q1<2Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com