
| A、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
| B、有化学键断裂的变化不一定是化学变化 |
| C、IA族元素形成的单质的熔点随原子序数的递增而降低 |
| D、无色透明溶液一定不是水 |
科目:高中化学 来源: 题型:
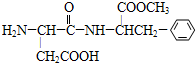 代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量共给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据图结构式判断下列关于aspartame的描述正确的是( )
代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量共给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据图结构式判断下列关于aspartame的描述正确的是( )| A、是芳香烃 |
| B、分子式是C14H19N2O5 |
| C、具有两性 |
| D、1mol aspartame最多能与3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
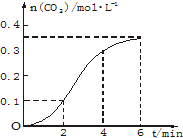 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是( )| A、反应开始4 min内温度对反应速率的影响比浓度小 |
| B、反应4 min后平均反应速率最小 |
| C、反应开始2 min内平均反应速率最大 |
| D、反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1?(L?min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| A、①发生氧化还原反应生成了过氧化钠 |
| B、④只发生物理变化 |
| C、③是碳酸钠吸收空气中的水蒸气形成了溶液 |
| D、②变白色主要是因为生成了氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L Na2CO3溶液:c(Na+)=2[c(CO32-)+c(HCO3-)+2c(H2CO3)] |
| B、pH约为4的 NaHSO3溶液:c(HSO3-)>c(SO32-)>c (H2SO3) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、向高锰酸钾溶液中滴加草酸溶液得到的pH=5的混合溶液:c(K+)=c(MnO4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、②③⑤ |
| C、①②⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+1 | B、+2 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H4 |
| B、C2H4 |
| C、C4H6 |
| D、C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com